Axit nitoric và muối nitrat - Chuyên đề Hóa 11
A. AXIT NITRIC
I. Cấu tạo phân tử:
- Công thức phân tử của Axit nitoric là: HNO3
- Công thức cấu tạo:
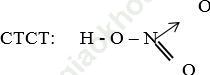
II. Tính chất vật lý
- Axit nitoric là chất lỏng không màu (D = 1.53g/cm3), không bền, khi có ánh sáng và phân hủy một phần.
4HNO3 → 4NO2 + O2 + 2H2O
- Axit nitric tan vô hạn trong nước.
III. Tính chất hóa học của Axit nitoric
1. Tính axit: Axit nitoric là một trong số các axit mạnh nhất, trong dung dịch:
HNO3 → H+ + NO3-
- Dung dịch axit HNO3 có đầy đủ tính chất của môt dung dịch axit như: Làm đỏ quỳ tím, tác dụng với oxit bazơ, bazơ, muối của axit yếu hơn.
2. Tính oxi hóa:
Kim loại hay phi kim khi gặp axit HNO3 đều bị oxi hóa về trạng thái oxi hóa cao nhất.
a) Với kim loại:
HNO3 oxi hầu hết các kim loại (trừ vàng (Au) và platin (Pt))
Ví dụ: Cu + 4HNO3(đ) → Cu (NO3)2 + 2NO2 + 2H2O.
3Cu + 8HNO3(l)→ 3Cu (NO3)2 + 2NO + 4H2O.
+ Fe, Al, Cr bị thụ động hóa trong dung HNO3 đặc nguội.
b) Với phi kim:
Khi đun nóng HNO3 đặc có thể tác dụng với phi: C, P, S... (trừ N2 và halogen)
S + 6HNO3(đ) → H2SO4 + 6NO2 + 2H2O
c) Với hợp chất:
- H2S, Hl, SO2, FeO, muối sắt (II)... có thể tác dụng với HNO3 nguyên tố bị oxi hoá trong hợp chất chuyển lên mức oxi hoá cao hơn.
Ví dụ:
3FeO + 10HNO3(d) → 3Fe (NO3)3 + NO + 5H2O
3H2S + 2HNO3(d) → 3S + 2NO + 4H2O
- Nhiều hợp chất hữu cơ như giấy, vải, dầu thông... bốc cháy khi tiếp xúc với HNO3 đặc.
V. Điều chế
1-Trong phòng thí nghiệm
NaNO3 (r) + H2SO4 (đ) to→ HNO3 + NaHSO4
Điện phân các muối nitrat của kim loại đứng sau H+ của nước (sau Al)
M (NO3)x +x/2 H2O đp→ M + x/4 O2 + xHNO3
2- Trong công nghiệp: NH3 → NO → NO2 → HNO3
B. MUỐI NITRAT
I. Tính chất vật lý: Dễ tan trong nước, là chất điện li mạnh trong dung dịch phân ly hoàn toàn thành các ion.
Ca (NO3)2 → Ca2+ + 2NO3-
- Ion NO3- không có
II. Tính chất hóa học:
Các muối nitrat của kim loại kiền và kiềm thổ có môi trường trung tính, muối của kim loại khác có môi trường axit (pH < 7).
1. Nhiệt phân muối Nitrat
a) Muối nitrat của các kim loaị hoạt động (trước Mg):
Nitrat → Nitrit + O2
Ví dụ: 2KNO3 to→ 2KNO2 + O2
b) Muối nitrat của kim loại từ Mg → Cu:
Nitrat → Oxit kim loại + NO2 + O2
Ví dụ: 2Cu (NO3)2 to→ 2CuO + 4NO2 + O2
c) Muối của những kim lạo kém hoạt (sau Cu):
Nitrat → kim loại + NO2 + O2
Ví dụ: 2AgNO3 to→ 2Ag + 2NO2 + O2
2. Ion NO3- trong H+ (axit)
NO3- + 4H+ + 3e → NO + 2H2O
Ví dụ: 3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO↑ + 2H2O
3. Ion NO3- trong OH-(kiềm): OXH được các kim loại lưỡng tính:
8Al + 3NO3- + 5OH- + 2H2O → 8AlO2- + 3NH3↑
4. Nhận biết ion nitrat (NO3-)
Trong môi trường axit, ion NO3- thể hiện tính oxi hóa giống như HNO3. Do đó, thuốc thử dùng để nhận biết ion NO3- là hỗn hợp vụn đồng và dung dịch H2SO4 loãng, đun nóng.
Hiện tượng:
Dung dịch có màu xanh, khí không màu hóa nâu đỏ trong không khí.
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2 NO↑ + 4H2O
2NO + O2 (không khí) → 2NO2 (màu nâu đỏ)
Bài trước: Amoniac và muối amoni - Chuyên đề Hóa 11