Axit, bazo, muối. pH của dung dịch - Chuyên đề Hóa 11
I. Axit, bazơ, muối
1. Axit và bazơ theo thuyết Areniut:
+) Axit: H2O → H+;
+) Bazơ: H2O → OH-
* Axit nhiều nấc:
Ví dụ: H3PO4 ⇌ H+ + H2PO4-
H2PO4- ⇌ H++ HPO42-
HPO42- ⇌ H+ + PO43-
* Bazơ nhiều nấc:
Ví dụ: Mg (OH)2 ⇌ Mg (OH)+ + OH-;
Mg (OH)+ ⇌ Mg2+ + OH-
* Hiđroxit lưỡng tính:
A (OH)n: Zn (OH)2, Pb (OH)2, Sn (OH)2, Cu (OH)2, Al (OH)3, Cr (OH)3.
+) Phân li theo kiểu bazơ:
Ví dụ: Zn (OH)2 ⇌ Zn2+ + 2OH-;
Al (OH)3 ⇌ Al3+ + 3OH-
+) Phân li theo kiểu axit:
Ví dụ: Zn (OH)2 ⇌ ZnO22- + 2H+; Al (OH)3 ⇌ AlO2- + H3O+
2. Axit, bazơ theo Bronsted:
Axit: Là chất (hoặc ion) nhường proton H+.
Bazơ: Là chất (hoặc ion) nhận proton H+.
Lưu ý:
Anion gốc axit còn H của axit yếu (H2CO3, H2SO3, H2S, H3PO4,... ) đều là chất lưỡng tính, còn anion không còn H của axit yếu đều là bazơ.
Hằng số phân li axit (Ka) và bazơ (Kb):
VD: CH3COOH ⇌ CH3COO- + H+
CH3COOH + H2O ⇌ CH3COO- + H+
VD: NH3 + H2O ⇌ NH4+ + OH-
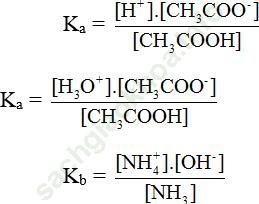
Sự điện li của muối trong nước:
Ví dụ: Na2SO4 → 2Na+ + SO42-
Muối axit, muối trung hoà:
+ Muối axit: Là muối mà gốc axit còn H có khả năng cho proton.
+ Muối trung hoà: Là muối mà gốc axit không còn H có khả năng cho proton.
II. Độ pH của dung dịch
| CÔNG THỨC | MÔI TRƯỜNG |
pH = - lg [H+] pOH = - lg [OH-] [H+]. [OH-] = 10-14 pH + pOH = 14 pH = a => [H+] = 10-a pOH = b => [OH+] = 10-b | pH < 7 → Môi trường axít pH > 7 → Môi trường bazơ pH = 7 → Môi trường trung tính [H+] càng lớn ↔ Giá trị pH càng bé [OH-] càng lớn ↔ Giá trị pH càng lớn |