Dạng 8: Phản ứng oxi hóa ancol - Chuyên đề Hóa 11
A. Phương pháp giải & Ví dụ minh họa
- Phản ứng oxi hóa không hoàn toàn:
+ Ancol bậc 1 khi bị oxi hóa bởi CuO (tº) cho ra sản phẩm là anđehit.
RCH2OH + CuO −tº→ RCHO + Cu↓ + H2O
+ Ancol bậc hai khi bị oxi hóa bởi CuO (tº) cho ra sản phẩm là xeton.
R–CH (OH)–R’ + CuO −tº→ R–CO–R’ + Cu↓ + H2O
+ Ancol bậc III khó bị oxi hóa.
Nhận xét: Khi oxi hóa không hoàn toàn ancol bằng CuO ta có:
Khối lượng chất rắn giảm = mCuO (phản ứng) – mCu (tạo thành)
- Oxi hóa hoàn toàn:
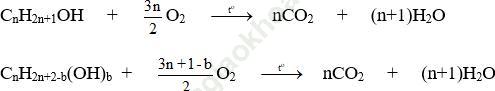
Nhận xét:

+ Áp dụng phương pháp đường chéo, bảo toàn khối lượng, bảo toàn nguyên tố. Đối với hỗn hợp ancol thì ngoài việc sử dụng phương pháp trên ta nên sử dụng phương pháp trung bình để tính toán.
Ví dụ minh họa
Bài 1: Cho m gam một ancol (rượu) no, đơn chức X qua bình đựng CuO (dư), nung nóng. Sau khi phản ứng hoàn toàn, khối lượng chất rắn trong bình giảm 0,32 gam. Hỗn hợp hơi thu được có tỉ khối đối với hiđro là 15,5. Giá trị của m là?
Bài giải:
Đặt công thức phân tử của ancol no, đơn chức X là: CnH2n + 2O
Phương trình phản ứng:
CnH2n + 2O + CuO → CnH2nO + H2O + Cu (1)
x
Khối lượng chất rắn giảm = mCuO – mCu = 80x – 64x = 0,32 → x = 0,02
Cách 1 (Áp dụng sơ đồ đường chéo): Hỗn hợp hơi gồm CnH2nO và H2O có khối lượng mol trung bình là: 15,5.2 = 31 gam/mol.
Áp dụng sơ đồ đường chéo ta có:
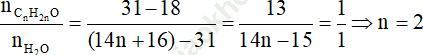
Vậy khối lượng của X là: m = (14n + 18).0,02 = (14.2 + 18).0,02 = 0,92 gam.
Cách 2 (Áp dụng định luật bảo toàn khối lượng): Hỗn hợp hơi gồm CnH2nO và H2O có khối lượng mol trung bình là 15,5.2 = 31 và có số mol là 0,02.2 = 0,04 mol.
Áp dụng định luật bảo toàn khối lượng ta có:
nCnH2n+2O = 0,02.64+0,04.31-0,02.80 = 0,92 gam.
Bài 2: Đốt cháy hoàn toàn 3,2 gam một chất hữu cơ A (C, H, O) dẫn toàn bộ sản phẩm lần lượt qua bình 1 chứa dung dịch H2SO4 đặc rồi qua bình 2 chứa dung dịch nước vôi trong dư. Bình 1 tăng 3,6 gam và bình 2 tạo ra 10 gam kết tủa. Xác định công thức cấu tạo của A.
Bài giải:
Gọi công thức phân tử của A là: CxHyOz
Khối lượng bình 1 tăng là khối lượng của H2O: nH2O = 3,6/18 = 0,2 mol
Bình 2 hấp thụ CO2: nCO2 = nkết tủa = 0,1 mol
Khối lượng nguyên tử O trong A: mO = 3,2 – 0,2.2 – 0,1.12 = 1,6 g
⇒ nO = 0,1 mol
Ta có: x: y: z = 0,1: 0,4: 0,1 = 1: 4: 1
⇒ Công thức cấu tạo của A là: CH3OH
Bài 3: Đốt cháy hoàn toàn m gam 2 ancol là đồng đẳng kế tiếp của nhau thu được 0,3 mol CO2 và 7,65 g H2O. Mặt khác nếu cho m gam hỗn hợp 2 ancol trên tác dụng với Na thì thu được 2,8 lít khí H2 (đktc). Xác định CTPT của hai ancol trên?
Bài giải:
Gọi Công thức phân tử của hỗn hợp 2 ancol là: ![]()
Số mol H2O là: nH2O = 7,65/18 = 0,425 mol
Ta có: nH2O > nCO2 ⇒ ancol no ⇒ nancol = 0,425 – 0,3 = 0,125 mol
Số nguyên tử cacbon trong ancol là: ntb = 0,3/0,125 = 2,4
Phương trình phản ứng:
Vậy giá trị của a = 2
=> Công thức phân tử của 2 ancol là: C2H4(OH)2 và C3H6(OH)2
Bài 4: Oxi hóa 6 gam ancol đơn chức A bằng oxi không khí (có xúc tác và đun nóng) thu được 8,4 gam hỗn hợp anđehit, ancol dư và nước. Phần trăm A bị oxi hóa là?
Bài giải:
Đặt công thức của ancol là: RCH2OH.
Số mol O2 đã tham gia phản ứng là: nO2 = (8,4-6)/32 = 0,075 mol
Ta có PTPƯ như sau:
2RCH2OH + O2 → 2RCHO + 2H2O (1)
mol: 0,15 ← 0,075
Theo (1) ta thấy số mol RCH2OH đã phản ứng là 0,15 mol, theo giả thiết sau phản ứng ancol còn dư nên => Số mol ancol ban đầu phải lớn hơn 0,15 mol.
Vì vậy: mRCH2OH < 6/0,15 = 40 ⇒ R < 9
⇒ R là H, ancol A là CH3OH.
Hiệu suất phản ứng oxi hóa ancol là: 0,15.32.100/6 = 80%
B. Bài tập trắc nghiệm
Bài 1: Đốt cháy hoàn toàn 1 ankanol X thu được 2,24 lít CO2 (đktc) và 3,6 gam H2O. Vậy X là?
A. CH4O. B. C2H6O. C. C3H8O. D. C4H10O.
Đáp án: B
nCO2 = 0,1 mol; nH2O = 0,15 mol ⇒ nancol = 0,05 mol
⇒ n = 2
Vậy X là: C2H6O
Bài 2: Đốt cháy hoàn toàn 3,48 gam hỗn hợp X gồm 2 ankanol đồng đẳng liên tiếp cần vừa đủ 4,032 lít O2 (đktc). Vậy công thức phân tử của 2 ankanol trong hỗn hợp X là?
A. CH3OH và C2H5OH. B. C2H5OH và C3H7OH.
C. C3H7OH và C4H9OH. D. C4H9OH và C5H11OH.
Đáp án: A
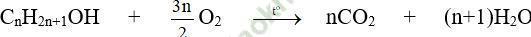
nO2 = 0,18 mol;
⇒ ![]()
Vậy công thức phân tử của 2 ankanol trong hỗn hợp X là: CH3OH và C2H5OH
Bài 3: Đốt cháy hoàn toàn 1 ankanol X cần hết 13,44 lít O2 (đktc) thu được CO2 và 9 gam H2O. Vậy X là?
A. CH4O. B. C2H6O. C. C3H8O. D. C4H10O.
Đáp án: D
nO2 = 0,6 mol; nH2O = 0,5 mol ⇒ 1,5n/ (n+1) = 0,6/0,5
⇒ n = 4
Vậy X là: C4H10O
Bài 4: Đốt cháy hoàn toàn 24,8 gam hỗn hợp gồm ancol metylic, ancol etylic, ancol propylic cần hết V lít O2 (đktc) thu được 2,6 mol hỗn hợp CO2 và H2O. Vậy giá trị của V là?
A. 57,36. B. 35,84. C. 33.60. D. 44,80.
Đáp án: C
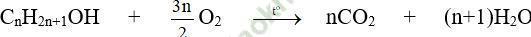
nCO2 = x mol; nH2O = y mol; nancol = z mol;
Ta có: x + y = 2,6 (1);
12x + 2y + 16z = 24,8 (2)
y – x = z (3)
Từ (1), (2), (3) ⇒ x = 1, y = 1,6, z = 0,6
⇒ nO2 = (2.1+1,6-0,6)/2 = 1,5 mol ⇒ V = 33,6 lít.
Bài 5: Oxi hoá 9,2 gam ancol etylic bằng CuO đun nóng thu được 13,2 gam hỗn hợp gồm anđehit, axit, ancol dư và nước. Hỗn hợp này tác dụng với Na sinh ra 3,36 lít H2 (ở đktc). Phần trăm ancol bị oxi hoá là:
A. 25%. B. 50%. C. 75%. D. 90%.
Đáp án: C
Theo giả thiết ta có:
nO pư= nCuO = (13,2-9,2)/16 = 0,25 mol; nH2 = 3,36/22,4 = 0,15 mol
Phương trình phản ứng:
CH3CH2OH + CuO → CH3CHO + H2O + Cu (1)
mol: x
CH3CH2OH + 2CuO → CH3COOH + H2O + Cu (2)
mol: y
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2 (3)
mol: z 0,5z
2CH3COOH + 2Na → 2CH3COOH + H2 (4)
mol: y 0,5y
2H2O + 2Na → 2NaOH + H2 (5)
mol: (x + y) 0,5 (x+y)
Theo các phương trình phản ứng và giả thiết ta có:
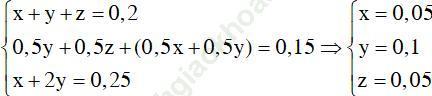
Vậy phần trăm khối lượng ancol bị oxi hóa là: (0,1+0,05)/0,2.100 = 75%
Bài 6: Đốt cháy hoàn toàn m gam hỗn hợp X gồm 0,1 mol etilenglicol và 0,2 mol ancol M thu được 35,2 gam CO2 và 19,8 gam H2O. Mặt khác cho m gam X phản ứng hoàn toàn với Na dư thu được 0,3 mol H2. Vậy ancol M là?
A. C3H8O. B. C3H8O2. C. C3H8O3. D. C4H10O2.
Đáp án: B
IMG_5
CT của M là: CnH2n+2Oa; nCO2 = 35,2/44 = 0,8 mol; nH2O = 19,8/18 = 1,1 mol
⇒ nCO2(M) = 0,8 – 0,2 = 0,6 mol ⇒ n = 3.
X tác dụng Na thu được 0,3 mol H2 ⇒ M là ancol 2 chức
Bài 7: Đốt cháy hoàn toàn hỗn hợp M gồm hai ancol X và Y là đồng đẳng kế tiếp của nhau, thu được 0,3 mol CO2 và 0,425 mol H2O. Mặt khác, cho 0,25 mol hỗn hợp M tác dụng với Na (dư), thu được chưa đến 0,15 mol H2. Công thức phân tử của X, Y là?
A. C2H6O2, C3H8O2. B. C2H6O, CH4O.
C. C3H6O, C4H8O. D. C2H6O, C3H8O.
Đáp án: D
nM = 0,425 – 0,3 = 0,125 mol
⇒ ntb = 2,4; 0,25 mol M thu được mol H2 nhỏ hơn 0,15
⇒ ancol đơn chức no mạch hở: C2H6O, C3H8O
Bài 8: Khi đốt cháy hoàn toàn m gam hỗn hợp hai ancol no, đơn chức, mạch hở thu được V lít khí CO2 (đktc) và a gam H¬2O. Biểu thức liên hệ giữa m, a và V là:

Đáp án: A
Vì các ancol là no đơn chức nên:
Áp dụng định luật bảo toàn khối lượng ta có:
⇒ m = a- V/5,6
Bài 9: Cho m gam ancol no đơn chức X qua bình đựng CuO (dư), nung nóng, sau khi phản ứng hoàn toàn khối lượng chất rắn trong bình giảm 0,32g. Hỗn hợp hơi thu được có tỉ lệ khối đối với hiđrô là 15,5, giá trị của m là:
A. 0,64 B. 0,46 C. 0,32 D.0,92
Đáp án: B
CnH2n + 2O + CuO → CnH2nO + H2O + Cu
mcr↓ = mO = 0,32 g ⇒ nO = 0,02 mol;
mhh hơi = 0,04.31 = 1,24 g ⇒ mancol = 1,24 – 0,32 = 0,92 g
Bài 10: Dẫn hơi C2H5OH qua ống đựng CuO nung nóng được 11,76 gam hỗn hợp X gồm anđehit, ancol dư và nước. Cho X tác dụng với Na dư được 2,24 lít H2 (ở đktc). % ancol bị oxi hoá là?
A. 80%. B. 75%. C. 60%. D. 50%.
Đáp án: D
CnH2n + 2O + CuO → CnH2nO + H2O + Cu
Gọi mol rượu dư, andehit là y, x mol
⇒ nrượu = x + y = 2nH2 = 0,2 mol;
Và 44x + 18x + 46y = 11,76 ⇒ x = 0,16 và y = 0,04
⇒ %ancol bị oxi hóa = 0,16/0,2.100%= 80%