12 dạng bài tập về Sự điện li trong đề thi Đại học có giải chi tiết - Chuyên đề Hóa 11
Dạng 1: Tính nồng độ các ion trong dung dịch chất điện li
Phương pháp:
+ Viết phương trình điện li
+ Biểu diễn số mol của các chất ở các thời điểm: ban đầu, phản ứng, cân bằng. Sử dụng các dữ kiện đề bài để thiết lập mối liên quan.
+ Thường sử dụng công thức độ điện li: 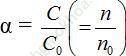
+ Thường sử dụng phương pháp bảo toàn điện tích.
Ví dụ minh họa
Ví dụ 1: Nồng độ mol của các ion CH3COOH, CH3COO-, H+ tại cân bằng trong dung dịch CH3COOH 0,1M có a = 1,32% là:
A. [CH3COOH] = 0,1M
B. [H+]= [CH3COO-] = 0,1M
C. [H+]= [CH3COO-] = 1,32.10-3M; [CH3COOH] = 0,09868M
D. [H+]= [CH3COO-] = 1,32.10-3M
Bài giải:
CH3COOH ⇔ H+ + CH3COO- (1)
Ban đầu: Co 0 0
Phản ứng: Co. a Co. a Co. a
Cân bằng: Co(1-a) Co. a Co. a
Vậy: [H+]= [CH3COO-] = a. Co = 0,1.1,32.10-2M = 1,32.10-3M
[CH3COOH] = 0,1 – 0,00132 = 0,09868M
⇒ Đáp án đúng là: C
Ví dụ 2: Trộn 100 ml dung dịch BaCl2 0,10M với 100ml dung dịch NaCl 0,10M. Nồng độ ion Cl- có mặt trong dung dịch là:
A. 0,2
B. 0,15
C. 0,3
D. 0,4
Bài giải:
nBaCl2 = 0,01 mol; nNaCl = 0,01 mol
BaCl2 → Ba2+ + 2Cl2
0,01 → 0,02 (mol)
NaCl → Na+ + Cl-
0,01 → 0,01 (mol)
nCl- = 0,03 ⇒ [Cl-] = 0,03/ (0,1+0,1)= 0,15 mol
⇒ Đáp án đúng là: B
Ví dụ 3: Một dung dịch X chứa 0,02mol Cu2+; 0,03mol K+; x mol Cl- và y mol SO42-. Tổng khối lượng các muối tan trong dung dịch là 5,435g. Giá trị của x và y lần lượt là:
A. 0,01 và 0,03
B. 0,02 và 0,05
C. 0,05 và 0,01
D. 0,03 và 0,02
Bài giải:
Theo định luật bảo toàn điện tích ta có:
2nCu2+ + nK+ = nCl- + 2nSO42-
⇒ x + 2y = 0,07 mol (1)
mmuối = mCu2+ + mK+ + mCl- + mSO42- = 5,435
⇒ 35,5x + 96y = 2,985 (2)
Từ (1) và (2) ⇒ x = 0,03; y = 0,02
⇒ Đáp án đúng là: D
Dạng 2: Tính độ điện li α
Phương pháp:
+ Viết phương trình điện li của các chất.
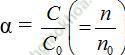
Ví dụ minh họa
Ví dụ 1: Độ điện li của axit HCOOH 0,007M trong dung dịch có [H+]=0,001M là:
A. 7
B. 1
C. 1/6
D. 1/7
Bài giải:
Gọi a là độ điện li của axit. Ta có:
HCOOH ⇔ H+ + HCOO-
Ban đầu: 0,007 0
Phản ứng: 0,007a 0,007a
Cân bằng: 0,007 (1-a) 0,007a
[H+] = 0,007a = 0,001⇒ a = 1/7
⇒ Đáp án đúng là: D
Ví dụ 2: Dung dịch CH3COOH 0,043M có độ điện li α = 20%. Nồng độ H+ tại thời điểm cân bằng là:
A. 8,6.10-3
B. 4,3.10-2
C. 4,3.10-3
D. 8,6.10-2
Bài giải:
CH3COOH ⇔ CH3COO- + H+
Ban đầu: 0,043M 0 0
Phản ứng: 0,043. α 0,043. α
Cân bằng: 0,043 – 0,043α 0,043α
Tại thời điểm cân bằng: [H+] = 0,043α = 8,6.10-3 (M)
⇒ Đáp án đúng là: A
Dạng 3: Tính pH của dung dịch không xảy ra phản ứng
pH = -lg [H+]
pOH = -lg [OH-]
pH + pOH = 14
Dạng 3.1: Tính pH của dung dịch axit mạnh, bazơ mạnh
Lưu ý: Tùy thuộc vào nồng độ của dung dịch axit hoặc bazơ để tính đến sự điện li của nước.
- Với axit: Ca là nồng độ của axit (HA)
+ Nếu Ca > 4,47.10-7 bỏ qua sự điện li của H2O ⇒ [H+] chỉ sinh ra do quá trình điện li của axit.
+ Nếu Ca < 4,47.10-7, thì dung dịch axít là rất loãng và tính đến sự phân li của H2O. Giải phương trình bậc 2 của [H+]:
[H+]2 – [H+]Ca – 10-14 = 0
Giải ra [H+] ⇒ pH
- Với bazơ: Cb là nồng độ của bazơ (BOH)
+ Nếu Cb > 4,47.10-7 bỏ qua sự điện li của H2O ⇒ [OH-] = Cb
⇒ pH = 14 + lgCb
+ Nếu Cb < 4,47.10-7, thì dung dịch axít là rất loãng và tính đến sự phân li của H2O. Giải phương trình bậc 2 của [OH-]:
[OH-]2 – [OH-]Cb – 10-14 = 0
Giải ra [OH-] ⇒ pH
Ví dụ minh họa
Ví dụ 1: pH của dung dịch axit HCl có nồng độ 0,01M và 2.10-7M lần lượt là:
A. 2 và 6,6
B. 2 và 6,7
C. -2 và -6,6
D. -2 và -6,7
Bài giải:
+ Với nồng độ 0,01 > 4,47.10-7 ⇒ [H+] = CM HCl = 0,01
pH = -lg [H+] = 2
+ Với nồng độ 2.10-7 < 4,47.10-7 ta có:
[H+]2 – [H+]Ca – 10-14 = 0
⇒ [H+] = 2,414.10-7 hoặc [H+] = -4,142.10-8 (loại)
⇒ pH = -lg [H+] = -lg (2.414.10-7) = 6,6
⇒ Đáp án đúng là: A
Ví dụ 2: Dung dịch Ba (OH)2 0,01M; NaOH 2,5.10-7M có pH lần lượt là:
A. 2 và 6,6
B. 2 và 7,45
C. 12,3 và 7,45
D. 12,3 và 7,4
Bài giải:
+ 0,01 > 4,47.10-7 bỏ qua sự điện li của nước⇒ [OH-] = 2CMBa (OH)2 = 0,02
pOH = -lg [OH-] = 1,7 ⇒ pH = 14 – 1,7 = 12,3
+ 2,5.10-7 < 4,47.10-7 tính cả sự điện li của nước
⇒ [OH-]2 – 2,5.10-7. [OH-] – 10-14 = 0
⇒ [OH-] = 2,85.10-7 ⇒ pH = 14 + lg [OH-] = 7,45
⇒ Đáp án đúng là: C
Dạng 3.2: Tính pH của dung dịch axit yếu, bazơ yếu
Phương pháp:
+ Sử dụng độ điện li α
+ Hằng số phân li axit Ka; hằng số phân li bazơ Kb
Lưu ý: Với axit yếu dạng HA; bazơ yếu dạng BOH:
pH =- 1/2 (logKa + logCa)= -log (αCa) (khi Ka.Ca > 2.10-13)
pH = 14 + 1/2 (logKb + logCb) (khi Kb.Cb > 2.10-13)
Nếu Ka.Ca < 2.10-13 hoặc Kb.Cb < 2.10-13 sẽ tính đến sự điện li của H2O giải phương trình bậc 3 của [H+] hoặc [OH+] để tính pH:
[H+]3 + Ka. [H+]2 – (10-14 + Ka.Ca). [H+] – 10-14.Ka = 0
[OH-]3 + Kb. [OH-]2 – (10-14 + Kb.Cb). [OH-] – 10-14.Kb = 0
Ví dụ minh họa
Ví dụ 1: Biết hằng số phân li của axit CH3COOH là Ka = 1,8.10-5, pH của dung dịch CH3COOH 0,1M là?
A. 4,7
B. 2,88
C. 1
D. 2
Bài giải:
CH3COOH ⇔ CH3COO- + H+
Ban đầu: 0,1M 0 0
Phân li: x x x (M)
Cân bằng: 0,1 – x x x (M)
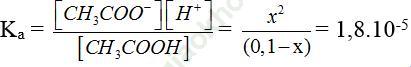
⇒ x = 1,33.10-3 ⇒ pH = 2,88
⇒ Đáp án đúng là: B
Ví dụ 2: Coi Fe3+ trong dung dịch chỉ tồn tại sự điện li được biểu diễn bằng phương trình sau:
Fe3+ + H2O ⇔ Fe (OH)2+ + H3O+ Ka = 10-2,2
pH của dung dịch FeCl3 0,05M là:
A. 1,3
B. 2,4
C. 1,75
D. 1,5
Bài giải:
Ka.Ca > 2.10-13
⇒ pH =- 1/2 (logKa + logCa)= 1,75 ⇒ Đáp án C
Ví dụ 3: pH của dung dịch CH3-NH2 0,2M có Kb = 4,4.10-4 là:
A. 0,7
B. 13,3
C. 11,63
D. 11,97
Bài giải:
Kb.Cb > 2.10-13 ⇒ pH = 14 + 1/2 (logKb + logCb) = 11,97
⇒ Đáp án đúng là: D
Ví dụ 4: Dung dịch natri benzoat (C6H5COONa) có nồng độ 2.10-5 và Ka(C6H5COOH) = 6,29.10-5 có pH là:
A. 6,94
B. 7,06
C. 9,3
D. 8,04
Bài giải:
C6H5COONa → C6H5COO- + Na+
C6H5COO- + H2O ⇔ C6H5COOH + OH-
Kb (C6H5COO-)= 10-14: Ka = 1,59.10-10
Kb.Cb < 2.10-13 ⇒ Tính cả sự điện li của H2O
Ta có: [OH-]3 + Kb. [OH-]2 – (10-14 + Kb.Cb). [OH-] – 10-14.Kb = 0
⇒ [OH-] = 1,146.10-7 ⇒ pH = 14 – pOH = 7,06
⇒ Đáp án đúng là: B
Dạng 3.3: Tính pH của hỗn hợp dung dịch axit mạnh và axit yếu; bazơ mạnh và bazơ yếu
Phương pháp:
Axit mạnh HA (Ca); axit yếu HB (Cb; Kb)
HA → H+ + A-
Ca Ca
HB H+ + B-
Bđ: Cb Ca
Pư: x x x
CB: Cb –x Ca + x
x Ta có: ![]()
+ Với bazơ tương tự
Ví dụ minh họa
Ví dụ 1: Trộn 10ml dung dịch HCl 0,01M với 10ml dung dịch CH3COOH 0,1M. pH của dung dịch thu được là (Ka (CH3COOH) = 10-4,76):
A. 2,13
B. 1,26
C. 2,88
D. 0,46
Bài giải:
CHCl = 0,01.10/20 = 5.10-3; CCH3COOH = 5.10-2
Ta có: Ca.Ka > 2.10-13 ⇒ Bỏ qua sự điện li của H2O
HCl → H+ + Cl-
5.10-3 5.10-3
CH3COOH ⇔ H+ + CH3COO-
Bđ: 5.10-2 5.10-3
Pư: x x x
CB: 5.10-2 –x 5.10-3 + x x
Ta có:
⇒ x = 2,36.10-3 ⇒ [H+] = 7,36.10-3
pH = 2,13 ⇒ Đáp án đúng là: A
Ví dụ 2: pH của dung dịch gồm NaOH 10-4 M và NaNO2 0,1M biết Kb = 10-10,71 là:
A. 4
B. 6
C. 8
D. 10
Bài giải:
Ta có: Cb.Kb = 10-10,71.0,1 = 10-11,71 > 2.10-13 nên có thể xem sự điện li của H2O là không đáng kể:
NaOH → Na+ + OH-
10-4 10-4
NO2- + H2O ⇔ OH- + HNO2
BD: 0,1 10-4
Pư: x x x
CB: 0,1 – x 10-4 + x x
Kb = 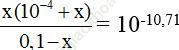
⇒ [OH-] = C1 + x = 1,95.10-8 +10-4
⇒ pOH = 4 ⇒ pH = 10 ⇒ Đáp án đúng là: D
Dạng 3.4: Tính pH của dung dịch axit, bazơ yếu đa chức
Phương pháp:
Đa axit: HnA:
HnA Hn-1A- + H+ Ka1
Hn-1A Hn-2A2- + H+ Ka2
………………………….
HA1-n An- + H+ Kan
Có thể coi đa axit như một hỗn hợp gồm các đơn axit:
Ka1 Ka2... Kan. Có thể coi sự phân li của axit chủ yếu xảy ra ở nấc 1
+ Tương tự với đa bazơ
Ví dụ minh họa
Ví dụ 1: Giá trị pH của của dung dịch H2S 0,1M là.
Biết H2S có Ka1 = 10-7; Ka2 = 10-12,92
A. 2
B. 4
C. 6
D. 8
Bài giải:
H2S ⇔ H+ + HS- Ka1 = 10-7
HS- ⇔ H+ + S2- Ka2 = 10-12,92
Ka1 ≥ Ka2 nên dung dịch cân bằng xảy ra chủ yếu ở nấc 1
H2S ⇔ H+ + HS-
BĐ: 0,1
Pư: x x x
CB: 0,1 –x x x
Ka1 = 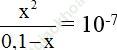
⇒ pH = 4 ⇒ Đáp án đúng là: B
Ví dụ 2: Dung dịch Na2S 0,010M, Ka1 = 10-7; Ka2 = 10-12,92 có pH bằng:
A. 10
B. 11
C. 11,95
D. 12
Bài giải:
Na2S → 2Na+ + S2-
S2- + H2O ⇔ HS- + OH- Kb1 = 10-14: Ka1 = 10-1,08
HS- + H2O ⇔ H2S + OH- Kb2 = 10-14: Ka2 = 10-7
Kb1 ≥ Kb2 nên trong dung dịch cân bằng chủ yếu ở nấc 1
S2- + H2O ⇔ HS- + OH-
CB: 0,01-x x x
Ta có: = Kb1 ⇒ x = 9.10-3
⇒ pH = 14 - pOH = 14 + log (9.10-3) = 11,95 ⇒ Đáp án C
Dạng 3.5: Tính pH của dung dịch đệm (Axit yếu và bazơ liên hợp)
Phương pháp:
Bài toán có dạng axit HA có nồng độ Ca và hằng số Ka liên hợp với A- có nồng độ Cb
pH = pKa + log Cb/Ca
Ví dụ minh họa
Ví dụ 1: Đổ 100ml dung dịch CH3COOH 0,1M vào 50ml dung dịch CH3COONa 0,4M thu được dung dịch có pH là (Biết CH3COOH có pKa = 4,76):
A. 2
B. 4,06
C. 5,06
D. 3,12
Bài giải:
Dung dịch đệm có Ca = 0,1.100/ (100+50)=1/15; Cb = 0,4.50/150 = 2/15
pH = pKa + log Cb/Ca = 5,06 ⇒ Đáp án đúng là: C
Ví dụ 2: pH của dung dịch chứa HCN 0,005M và NaCN 0,5M có Ka = 10-9,35 là:
A. 11
B. 11,02
C. 11,5
D. 11,32
Bài giải:
Dung dịch đệm có: Ca = 0,005M; Cb= 0,5M
pH = pKa + log Cb/Ca = 9,35 + log0,5/0,005 = 11,32
⇒ Đáp án đúng là: D
Dạng 3.6: Tính pH của dung dịch chất lưỡng tính
Phương pháp:
Thường bắt gặp các dung dịch có chứa ion: HSO3-; HCO3-; HS-; HPO42-. Các ion này vừa là axit yếu vừa là bazơ yếu nên chúng ta coi như bài toán chứa đồng thời axit yếu và bazơ yếu.
+ Thường sử dụng: H+ = √ (Ka1.Ka2) (Kw ≤ Ka2.C; Ka1-1.C ≥ 1)
Ví dụ minh họa
Ví dụ 1: pH của dung dịch NaHCO3 1M biết H2CO3 có Ka1 = 10-6,35; Ka2 = 10-10,33 là:
A. 7,02
B. 8,36
C. 9,01
D. 10,45
Bài giải:
Ta có: Kw ≤ Ka2.C; Ka1-1.C ≥ 1
⇒ H+ = ![]()
⇒ pH = 8,34
⇒ Đáp án đúng là: B
Dạng 4: Tính pH của dung dịch xảy ra phản ứng
Dạng 4.1: Tính pH của dung dịch axit mạnh và bazơ mạnh
Phương pháp:
+ Viết phương trình rút gọn: H+ + OH- → H2O
+ So sánh tỉ lệ mol để tìm ra H+ dư hay OH- dư
+ pH = -log [H+]dư; pH = 14 + log [OH-]dư
Ví dụ minh họa
Ví dụ 1: Trộn 100 ml dung dịch (gồm Ba (OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch (gồm H2SO4 0,0375M và HCl 0,0125M), thu được dung dịch X. Giá trị pH của dung dịch X là
A. 7. B. 2. C. 1. D. 6.
Bài giải:
nOH- = 2nBa (OH)2 + nNaOH = 2.0,1.0,1 + 0,1.0,1 = 0,03 mol
nH+ = 2nH2SO4 + nHCl = 2.0,0375.0,4 + 0,0125.0,4 = 0,035 mol
H+ + OH- → H2O
0,035 0,03 (mol)
⇒ H+ dư; nH+ dư = 0,035 – 0,03 = 0,005 mol
[H+]dư = 0,005/ (0,1+0,4)= 0,01M
⇒ pH = -lg [H+] = 2 ⇒ Đáp án đúng là: B
Ví dụ 2: Cho 40ml dung dịch HCl 0,75M vào 160 ml dung dịch Ba (OH)2 0,08M; KOH 0,04M. pH dung dịch thu được là:
A. 2 B. 3 C. 11 D. 12
Bài giải:
nOH- = 2.0,08.160.10-3 + 0,04.160.10-3 =0,032 mol;
nH+ = 0,75.40.10-3 = 0,03mol ⇒ OH- dư
[OH-]dư =
⇒ pH= 14 + log [OH-] = 12 ⇒ Đáp án đúng là: D
Dạng 4.2: Tính pH của dung dịch axit mạnh và bazơ yếu
Phương pháp:
+ Nếu axit mạnh lớn hơn lượng bazơ yếu thì pH tính theo dạng axit mạnh – axit yếu
+ Nếu axit nhỏ hơn lượng bazơ thì pH tính theo dung dịch hỗn hợp dung dịch bazơ yếu và axit yếu – dung dịch đệm
+ Nếu lượng axit bằng lượng bazơ thì thu được dung dịch axit yếu (liên hợp)
Dạng 4.3: Tính pH của dung dịch axit yếu và bazơ mạnh
Phương pháp:
+ Nếu axit yếu lớn hơn lượng bazơ mạnh thì tính Ph tính theo dung dịch hỗn hợp 2 axit yếu
+ Nếu axit yếu nhỏ hơn lượng bazơ mạnh thì pH tính theo công thức của dung dịch hỗn hợp bazơ mạnh và bazơ yếu
+ Nếu axit yếu bằng lượng bazơ mạnh thì pH tính theo công thức của dung dịch hỗn hợp bazơ yếu (liên hợp)
Dạng 4.4: Tính pH của dung dịch axit yếu và bazơ yếu
Phương pháp:
+ Nếu axit lớn hơn bazơ tạo ra dung dịch gồm 2 axit yếu
+ Nếu lượng axit yếu lớn hơn lượng bazơ thì tạo ra dung dịch 2 bazơ yếu
+ Nếu lượng axit bằng bazơ thì thu được dung dịch trung tính
Dạng 3.3: Pha trộn dung dịch
Phương pháp:
+ Sử dụng phương pháp đường chéo
+ Việc thêm, cô cạn nước làm thay đổi nồng độ mol/l và không làm thay đổi số mol chất
Lưu ý:
+ Nước có C% hoặc CM =0.
+ Thể khi trộn dung dịch thể tích dung dịch sau sẽ bằng tổng các thể tích đem trộn
Ví dụ minh họa
Ví dụ 1: Cho 10 ml dung dịch HCl có pH = 3. Thêm vào đó x ml nước cất và khuấy đều thu được dung dịch có pH = 4. Hỏi x bằng bao nhiêu?
A. 10. B. 40. C. 90. D. 100.
Bài giải:
nH+ ban đầu = nH+ sau
⇒ 10.10-3 = 10-4. (10+x)
⇒x = 90
=> Đáp án đúng là: C.
Ví dụ 2: Pha loãng 200ml dung dịch Ba (OH)2 bằng 1,2 lít nước thì thu được dung dịch có pH =13. Dung dịch ban đầu có p H bằng:
A. 12,45 B. 13 C. 13,5 D. 13,845
Bài giải:
Gọi [OH-] ban đầu = a (M)
Dung dịch sau có pH=13 ⇒ [OH]sau = 0,1
Ta có sơ đồ đường chéo:
200ml Ba (OH)2:
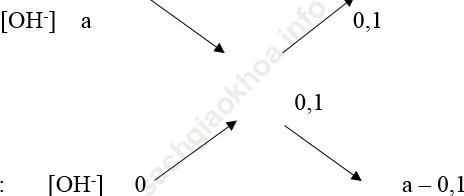
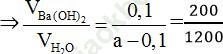
⇒ a = 0,7 ⇒ pH = 14 + log0,7 = 13,845
⇒ Đáp án đúng là: D
Dạng 6: Bảo toàn điện tích
Phương pháp:
+ Sử dụng định luật bảo toàn điện tích: Trong một dung dịch, tổng số mol các điện tích dương của ion dương và tổng số mol các điện tích âm của ion âm luôn luôn bằng nha
+ Khi cô cạn dung dịch, khối lượng chất rắn tạo ra bằng khối lượng các ion dương và ion âm có trong dung dịch (trừ H+ + OH- → H2O)
+ mmuối = mcation/NH4+ + manion
Ví dụ minh họa
Ví dụ 1: Cô cạn dung dịch có chứa 0,2 mol Mg2+; 0,1 mol Al3+, và ion NO3- thì thu được bao nhiêu gam muối khan là:
A. 55,3 gam B. 59,5 gam C. 50,9 gam D. 0,59 gam
Bài giải:
Theo Định luật bảo toàn điện tích: 2nMg2+ + 3nAl3+ = nNO3- = 0,7 mol
mmuối = 24.0,2 + 27.0,1 + 0,7.62= 50,9 gam
⇒ Đáp án đúng là: C
Ví dụ 2: Hòa tan hoàn toàn 10g hỗn hợp X gồm Mg và Fe bằng dung dịch HCl 2M. Kết thúc thí nghiệm thu được dung dịch Y và 5,6l khí H2 (đktc). Để kết tủa hoàn toàn các cation có trong Y cần vừa đủ 300ml NaOH 2M.
Thể tích dungdịch HCl đã dùng là:
A. 0,2 lít B. 0,24 lít C. 0,3 lít D. 0,4 lít
Khối lượng kết tủa thu được là:
A. 20,2g B. 18,5g C. 16,25 D. 13,5g
Bài giải:
nNa+ = nOH- = nNaOH = 0,6M
X + NaOH → dung dịch Y (Mg2+;Fe2+;H+ dư; Cl-)
NaOH + Y: Mg2+; Fe2+ kết tủa với OH-.
⇒ dung dịch thu được sau phản ứng chỉ chứa Na+ và Cl-.
⇒ nCl- = nNa+=0,6⇒ VHCl=0,6: 2= 0,3lít ⇒ Đáp án C
nHCl đã dùng = 0,6mol
nH2 = 0,25 mol ⇒ nHCl pư kim loại = 2nH2 = 0,5mol
⇒ nNaOH pư HCl = n HCl dư = 0,6 – 0,5 = 0,1 mol
nNaOH tạo kết tủa với kim loại = 0,6 – 0,1 = 0,5 mol
mkết tuả = mKL + mOH- = 10 + 0,5.17 = 18,5g
⇒ Đáp án đúng là: B
Ví dụ 3: Cho hòa tan hoàn toàn 15,6 gam hỗn hợp gồm Al vàAl2O3 trong 500 dung dịch NaOH 1M thu được 6,72 lít H2 (đktc)Và dung dịch X. Thể tích HCl 2M tối thiểu cần cho vào X để thu được lượng kết tủa lớn nhất:
A. 0,175 lít. B. 0,25 lít. C. 0,25 lít. D. 0,52 lít.
Bài giải:
Dung dịch X chứa các ion Na+; AlO2-; OH- dư (có thể). Áp dụng định luật Bảo toàn điện tích:
nAlO2- + nOH- = nNa+ = 0,5
Khi cho HCl vaof dung dịch X:
H+ + OH- → H2O (1)
H+ + AlO2- + H2O → Al (OH)3 ↓ (2)
3H+ + Al (OH)3 → Al3+ + 3H2O (3)
Để kết tủa là lớn nhất, thì không xảy ra (3) và n H+ = n AlO2- + n OH- = 0,5 mol
⇒ VHCl = 0,5/2 = 0,25 (lít) ⇒ Đáp án C
Bài tiếp: Dạng 1: Bài tập lý thuyết về sự điện li, chất điện li, viết phương trình điện li - Chuyên đề Hóa 11