Dạng 3: Phản ứng oxi hóa ankan - Chuyên đề Hóa 11
A. Phương pháp giải & Ví dụ minh họa
Phản ứng đốt cháy có dạng ankan:
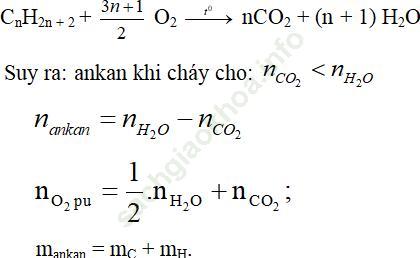
=> ankan khi cháy cho nCO2 < nH2O
nankan = nH2O – nCO2; nO2pu = nH2O + 1/2nCO2; mankan = mC + mH
* Nếu có hỗn hợp gồm gồm hai ankan:
CnH2n + 2: x mol
CmH2m + 2: y mol
Gọi công thức trung bình của hai ankan là:

- Có thể tính số mol hỗn hợp (x, y) dựa vào ntb và phương pháp đường chéo.
Ví dụ minh họa
Bài 1: Đốt cháy hoàn toàn 2,24 lít hỗn hợp X (đktc) gồm CH4, C2H6 và C3H8 thu được 4,48 lit khí CO2 (đktc) và m gam H2O. Tính giá trị của V.
Bài giải:
nX = 2,24/22,4 = 0,1 mol; nCO2 = 4,48/22,4 = 0,2 mol
nX = nH2O - nCO2 ⇒ nH2O = nCO2 + nX = 0,2 + 0,1 = 0,3 mol
⇒ m = 0,3.18 = 5,4 (gam)
Bài 2: Đốt cháy hoàn toàn 6 gam hỗn hợp X gồm hai ankhan cần hết 15,68 lít O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy vào nước vôi trong dư, thu được m gam kết tủa. Giá trị của m là
Bài giải:

Bài 3: Đốt cháy hoàn toàn 1 hidrocacbon A (là chất khí, đkc) rồi dẫn sản phẩm lần lượt qua bình 1 đựng H2SO4 đặc và bình 2 chứa NaOH dư người ta thấy khối lượng bình I tăng 1,8g và khối lượng bình 2 tăng 3,52 gam. Xác định Công thức phân tử của A.
Bài giải:
Khối lượng bình 1 tăng là khối lượng của H2O ⇒ nH2O = 1,8/18 = 0,1 mol
Khối lượng bình 2 tăng là khối lượng của CO2 ⇒ nCO2 = 3,52/44 = 0,08 mol
Nhận thấy: nCO2 < nH2O ⇒ hidrocacbon là ankan;
Số mol ankan là nankan = 0,1 – 0,08 = 0,02 mol
Phương trình phản ứng:
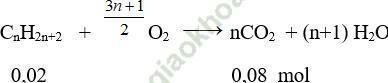
⇒ n = 0,08/0,02 = 4
Vậy công thức phân tử của A là: C4H10
Bài 4: Đốt cháy hoàn toàn 6,8g hỗn hợp khí X gồm: ankan A và CH4, sản phẩm cháy dẫn vào bình 1 đựng P2O5 và bình 2 đựng 1000 ml Ba (OH)2 0,5M. Sau thí nghiệm khối lượng bình 1 tăng 12,6g.
a. Tìm công thức phân tử của A, biết VA: VCH4 = 2: 3.
b. Tính khối lượng các chất trong X.
c. Tính khối lượng muối tạo thành.
Bài giải:
Ta có: VA: VCH4 = 2: 3 ⇒ nA: nCH4 = 2x: 3x
Khối lượng bình 1 tăng là khối lượng của H2O: nH2O = 12,6/18 = 0,7 mol
a. Gọi công thức phân tử của ankan là: CnH2n+2
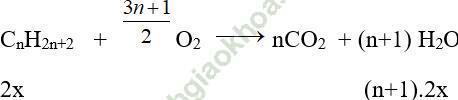
CH4 + 2O2 → CO2 + 2H2O
3x 6x
Ta có: (14n + 2).2x + 16.3x = 6,8 (1); (n + 1).2x + 6x = 0,7 (2)
Từ (1), (2) ⇒ x = 0,05 và nx = 0,15 ⇒ n = 3
Vậy Công thức phân tử của A là: C3H8
b. Khối lượng của mỗi an kan trong hỗn hợp X là:
mC3H8 = 2.0,05.44 = 4,4 gam
⇒ mCH4 = 6,8 – 4,4 = 2,4 gam
c. Số mol CO2 tạo thành là nCO2 = 2.0,15 + 3.0,05 = 0,45 mol
Số mol Ba (OH)2 là: nBa (OH)2 = 1.0,5 = 0,5 mol
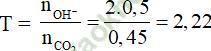 ⇒ chỉ tạo muối BaCO3
⇒ chỉ tạo muối BaCO3
Khối lượng muối tạo thành: mBaCO3 = 0,45.197 = 88,65 gam
Bài 5: Đốt cháy hoàn toàn một lượng hi đrocacbon X. Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ba (OH)2 (dư) tạo ra 29,55 gam kết tủa, dung dịch sau phản ứng có khối lượng giảm 19,35 gam so với dung dịch Ba (OH)2 ban đầu. Công thức phân tử X là?
Bài giải:
nC = nCO2 = nBaCO3 = 29,55/197 = 0,15 mol
mgiảm = mBaCO3 - (mCO2 + mH2O) = 19,35 mol ⇒ mCO2 + mH2O = 10,2g
mH2O = 10,2 – 0,15.44 = 3,6 (gam)
⇒ nH2O = 3,6/18 = 0,2 mol
⇒ nH = 0,4 mol
nC: nH = 0,15: 0,4 = 3: 8 ⇒ Công thức phân tử là: C3H8
B. Bài tập trắc nghiệm
Bài 1: Đốt cháy hiđrocacbon X, rồi hấp thụ hoàn toàn sản phẩm cháy vào dung dịch Ba (OH)2 dư, thấy có 49,25 gam kết tủa xuất hiện và khối lượng dung dịch sau phản ứng giảm đi 32,85 gam. Công thức phân tử của X là?
A. C5H12 B. C2H6 C. C3H8 D. C4H10
Đáp án: A
nCO2 = nBaCO3 = 49,25/197 = 0,25 mol; mCO2 + mH2O = 49,25 – 32,85 = 16,4
mH2O = 16,4 – 0,25.44 = 5,4; nH2O = 5,4/18 = 0,3 mol; nH2O > nCO2 ⇒ X là ankan;
Công thức phân tử của X là: CnH2n+2; n = 0,25/0,05 = 5⇒ X: C5H12
Bài 2: Khi đốt cháy hoàn toàn 7,84 lít hỗn hợp khí gồm CH4, C2H6, C3H8 (đktc) thu được 16,8 lít khí CO2 (đktc) và x gam H2O. Giá trị của x là?
A. 6,3. B. 13,5. C. 18,0. D. 19,8.
Đáp án: D
nH2O = nCO2 + nhh = 16,8/22,4+ 7,84/22,4 = 1,1 mol ⇒ x = 1,1.18 = 19,8 gam
Bài 3: Đốt cháy hoàn toàn 4,48 lít hỗn hợp gồm C2H6 và C3H8 (đkc) rồi cho sản phẩm cháy đi qua bình 1 đựng H2SO4 đặc, bình 2 đựng dung dịch nước vôi trong có dư thì thấy khối lượng bình 1 tăng m gam, bình 2 tăng 2,2 gam. m=?
A. 3,5 B. 4,5 C. 5,4 D. 7,2
Đáp án: B
m = (4,48/22,4+ 2,2/44).18= 4,5 gam
Bài 4: Đốt cháy hết 2,24 lít ankan X (đktc), dẫn toàn bộ sản phẩm cháy vào dd nước vôi trong dư thấy có 40g kết tủa. Công thức phân tử của X là?
A. C2H6 B. C4H10 C. C3H6 D. C3H8
Đáp án: B
Công thức phân tử của X là CnH2n+2; n = nCO2 /nX = 4
Bài 5: Đốt cháy hoàn toàn 0,56 lit butan (đktc) và cho sản phẩm cháy hấp thụ hoàn toàn vào 400ml dd Ba (OH)2 0,2M. Số gam kết tủa tạo thành:
A. 9,85g B. 9,98g C. 10,4g D.11,82g
Đáp án: D
nC4H10 = 0,56/22,4 = 0,025 mol ⇒ nCO2 = 4.0,025 = 0,1 mol; nH2O = 5.0,025 = 0,125 mol; T = nOH-/nCO2 = 0,16/0,1 = 1,6
⇒ tạo ra 2 muối; nCO32- = 0,06
⇒ mCaCO3 = 0,06.197 = 11,82 gam
Bài 6: Đốt cháy hết 2,24 lít ankan X (đktc), dẫn toàn bộ sản phẩm cháy vào dung dịch nước vôi trong dư thấy có 40g kết tủa. Công thức phân tử của X?
A. C2H6 B. C4H10 C. C3H6 D. C3H8
Đáp án: B
Công thức phân tử của X là CnH2n+2; n = nCO2 /nX = 4
Bài 7: Đốt cháy hoàn toàn một hi đrocacbon X thu được 0,11 mol CO2 và 0,132 mol H2O. Khi X tác dụng với khí Clo (theo tỉ lệ số mol 1: 1) thu được một sản phẩm hữu cơ duy nhất. Tên gọi của X là?
A. 2,2-đimetylprotan B. etan
C. 2-metylpropan D. 2- metylbutan
Đáp án: A
nH2O > nCO2 ⇒ X là ankan
X có công thức phân tử là CnH2n+2
nX = nH2O - nCO2 = 0,132 – 0,11 = 0,022 (mol)
⇒ 0,022n = 0,11 ⇒ n = 5 ⇒ CTPT: C5H12
C5H12 tác dụng với khí Clo thu được sản phẩm hữu cơ duy nhất nên công thức phân tử của X là:
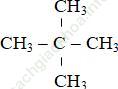
Bài 8: Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (đktc) và 9,9 gam nước. Thể tích không khí (dktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên niên trên là?
A. 70,0 lít B. 78,4 lít C. 84,0 lít D. 56,0 lít.
Đáp án: A
nCO2 = 7,84/22,4 - 0,35 mol; nH2O = 9,9/18 = 0,55 mol
Bảo toàn nguyên tố O:
2nO2 = 2nCO2 + nH2O ⇒ nO2 = 0,625 mol ⇒ VO2 = 0,625.22,4 = 14 lit
Vì oxi chiếm 1/5 Vkk ⇒ Vkk = 5.14 = 70 (lít)