Dạng 6: Phản ứng oxi hóa Benzen và đồng đẳng - Chuyên đề Hóa 11
A. Phương pháp giải & Ví dụ minh họa
- Oxi hóa hoàn toàn: CnH2n-6 + (3n-3)/2 O2 → n CO2 + (n-3)H2O
- Oxi hóa không hoàn toàn:
Benzen không làm mất màu dung dịch thuốc tím ở điều kiện thường và đun nóng.
Ankyl benzen không làm mất màu dung dịch thuốc tím ở điều kiện thường nhưng làm mất màu dung dịch thuốc tím khi đun nóng.
C6H5CH3 + 2KMnO4 → C6H5COOK + 2MnO2 + KOH + H2O
Ví dụ minh họa
Bài 1: Chất A là một đồng đẳng của benzen. Khi đốt cháy hoàn toàn 1,5 g chất A, người ta thu được 2,52 lít khí CO2 (đktc).
a. Xác định Công thức phân tử của A.
b. Viết các công thức cấu tạo của A và gọi tên.
c. Khi A tác dụng với Br2 có chất xúc tác Fe và nhiệt độ thì một nguyên tử H đính với vồng benzen bị thay thế bởi Br, tạo ra dẫn xuất monobrom duy nhất. Xác định công thức cấu tạo của A.
Bài giải:
Cứ (14n -6)g A tạo ra n mol CO2
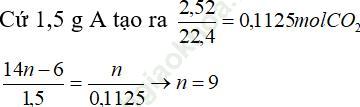
=> Công thức phân tử của A là: C9H12
b.
Các công thức cấu tạo của A là:
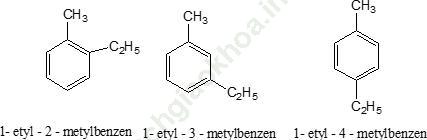
Bài 2: Đốt cháy hết 9,18 g 2 đồng đẳng của benzen A, B thu được 8,1 g H2O và CO2. Dẫn toàn bộ lượng CO2 vào 100ml dung dịch NaOH 1M thu được m g muối. Giá trị của m và thành phần của muối?
Bài giải:
mC = 9,18 – 0,45.2 = 8,28 gam; nCO2 = 0,69 mol; T = 0,1/0,69 = 0,14
⇒ Tạo muối NaHCO3
mNaHCO3 = 0,1.84 = 8,4 g
Bài 3: Để oxi hoá hết 10,6 gam o-xylen (1,2-đimetylbenzen) cần bao nhiêu lít dung dịch KMnO4 0,5M trong môi trường H2SO4 loãng. Giả sử dùng dư 20% so với lượng phản ứng.
Bài giải:
Ta có:
no-Xilen = 10,6/ 106 = 0,1 mol
⇒ nKMnO4 pư = 0,1.2 = 0,2 mol; dùng dư 20%
⇒ nKMnO4 = 0,2.120/100 = 0,24 mol
⇒ V = 0,24/0,5 = 0,48 lít.
Vậy cần 0.48 lít dung dịch KMnO4 0,5M
Bài 4: Đốt cháy hết 9,18 g 2 đồng đẳng của benzen A, B thu được H2O và 30,36 g CO2. Cộng thức phân tử của A và B lần lượt là?
A. C8H10; C9H14 B. C8H10; C9H12
C. C8H12; C9H14 D. C8H14; C9H16
Bài giải:
nCO2 = 30,36/44 = 0,36 mol
⇒ nhh = 0,36/ntb
M = 306ntb/23 ⇒ ntb = 8,625
⇒ Công thức phân tử của A và B là: C8H10; C9H12
B. Bài tập trắc nghiệm
Bài 1: Đốt cháy hoàn toàn 9,2g một ankyl benzen A thu được 30,8g CO2. Công thức phân tử của A là?
A.C6H6 B. C8H10 C. C7H8 D. C9H12
Đáp án: C
nCO2 = 0,7 mol; MA = 13,1n
⇒ n = 7
=> Công thức phân tử của A là C7H8
Bài 2: Đốt cháy 12,72 g A (CxHy) → 10,8g H2O. A có chứa 1 vòng benzen. Công thức phân tử của A là?
A. C3H4 B. C8H10 C. C9H12 D. C12H16
Đáp án: B
nH2O = 0,6 mol; MA = (12,72. (n-3))/0,6
⇒ n = 8
=> Công thức phân tử của A là C8H10
Bài 3: Đốt cháy hoàn toàn m g A đồng đẳng của benzen thu được 20,16 lít CO2 (đktc) và 10,8 ml H2O (lỏng). Công thức phân tử của A là?
A. C7H8 B. C8H10
C. C9H12 D. C10H14
Đáp án: C
nCO2 = 20,16/22,4 = 0,9 mol; nH2O = 10,8/18 = 0,6 mol; 0,9/0,3 = n/ (n-3)
⇒ n = 9
=> Công thức phân tử của A là C9H12
Bài 4: Đốt cháy hoàn toàn 0,1 mol CxHy thu được 15,68 lít CO2 (đktc) và 7,2 g H2O (lỏng). Công thức phân tử của CxHy là?
A. C7H8 B. C8H10 C. C10H14 D. C9H12
Đáp án: A
nCO2 = 0,7 mol; nH2O = 0,4 mol;
⇒ x = 7; y = 8
Công thức phân tử của CxHy là C7H8
Bài 5: Đốt cháy hết m gam 2 đồng đẳng của benzen A, B thu được 4,05 gam H2O và 7,728 lítCO2 (đktc). Giá trị của m và số tổng số mol của A, B là?
A. 4,59 và 0,04. B. 9,18 và 0,08. C. 4,59 và 0,08. D. 9,14 và 0,04.
Đáp án: A
nCO2 = 7,728/ 22,4 = 0,345 mol; nH2O = 4,05/18 = 0,225
⇒ m = mC + mH = 0,345.12 + 0,225.2 = 4,59 g; n = (0,345 – 0,225)/3 = 0,04 mol
Bài 6: Đốt cháy hoàn toàn ankybenzen X thu được 7,84 lít CO2 (đktc) và 3,6 gam H2O. Công thức phân tử của X là?
A.C6H6 B. C7H8 C. C8H8 D. C8H10
Đáp án: B
Đặt Công thức phân tử của X là CnH2n-6
3nX = nH2O - nCO2 = 0,35 – 0,2 = 0,15 mol → nX = 0,05 mol
→ 0,05n = 0,35 → n = 7
→ Công thức phân tử của X là C7H8
Bài 7: Đốt cháy hoàn toàn Hiđrocacbon X, thu được CO2 và H2O có số mol theo tỉ lệ tương ứng 2: 1. Mặt khác, 1 mol X tác dụng được tối đa với 4 mol H2 (Ni, t°): 1 mol X tác dụng được tối đa 1 mol Br2. Công thức phân tử của X là?
A. C2H2 B. C4H4 C. C6H6 D. C8H8
Đáp án: D
Ta có: nC: nH = 2: (1.2) = 1: 1 → Công thức phân tử của X là: CnHn
1 mol X + 4 mol H2 (Ni, to); 1 mol X + 1 mol Br2
→ X chứa vòng benzen + 1 liên kết đôi ở nhánh → k = 5
Công thức phân tử của X là: CnH2n+2-2k → 2n + 2 – 2k = n
→ k = 5; n = 8
→ Công thức phân tử của X là: C8H8
Bài 8: Đốt cháy hoàn toàn 5,3 gam ankybenzen X thu được 8,96 lít CO2 (đktc). Công thức phân tử của X là?
A.C6H6 B. C7H8 C. C8H8 D. C8H10
Đáp án: D
Đặt Công thức phân tử của X là CnH2n-6
→ Công thức phân tử của X là: C8H10