Dạng 4: Phản ứng đốt cháy của Anken, Ankađien, Ankin - Chuyên đề Hóa 11
A. Phương pháp giải & Ví dụ minh họa
a/ Anken
Lý thuyết và Phương pháp giải
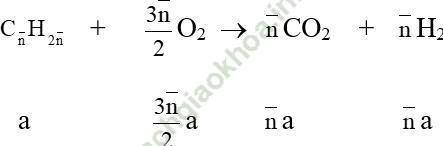
• Khi đốt cháy một hoặc nhiều hiđrocacbon thuộc cùng dãy đồng đẳng, ta tính được:
nCO = nH2O hoặc nO = 1,5nCO = 1,5nH2O
→ Các hiđrocacbon đó là anken hay xicloankan.
• Đốt cháy hỗn hợp ankan + anken (xicloankan) thì:
nCO < nH2O hoặc nO2 > 1,5nCO2 và nankan = nH2O - nCO = 2 (nO2- 1,5nCO2)
Ví dụ minh họa
Bài 1: Đem đốt cháy hoàn toàn 0,1 mol hỗn hợp X gồm 2 anken là đồng đẳng kế tiếp nhau thu được CO2 và nước có khối lượng hơn kém nhau 6,76 gam.
a. Tìm công thức phân tử của 2 anken đó?
b. Tính phần trăm khối lượng mỗi anken trong hỗn hợp X.
Bài giải:
Ta có phương trình đốt cháy như sau:
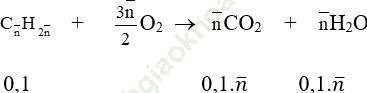
a. Ta có: 44.0,1. ntb - 18.0,1. ntb = 6,76 → ntb = 2,6 mol
Vậy công thức phân tử của 2 anken đó là: C2H4 và C3H6
b. Áp dụng sơ đồ đường chéo
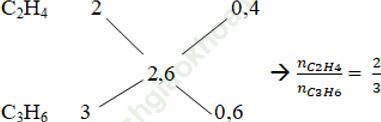
Số mol của C2H4 và C3H6 là: nC2H4 = 0,1.2/5 = 0,4 mol; nC3H6 = 0,1.3/5 = 0,6 mol
Phần trăm khối lượng của mỗi anken là:

Bài 2: Đốt cháy hoàn toàn 2,24 lít đkc 1 hiđrocacbon X mạch hở, sau đó dẫn sản phẩm cháy lần lượt qua dung dịch H2SO4 và dung dịch Ca (OH)2 dư. Sau thí nghiệm thấy khối lượng bình đựng dung dịch axit tăng 5,4g, bình đựng dung dịch Ca (OH)2 có 30g kết tủa. Tìm công thức phân tử của X.
Bài giải:
Số mol X là: nX = 2,24/22,4 = 0,1 mol
Khối lượng bình đựng dung dịch axit tăng là khối lượng của H2O:
mH2O = 5,4 gam ⇒ nH2O = 5,4/18 = 0,3 mol
Số mol CO2 là: nCO2 = nCaCO3 = 30/100 = 0,3 mol
Nhận thấy: nH2O = nCO2 ⇒ hidrocacbon X là anken
Phương trình đốt cháy:
CnH2n + 3n/2 O2 → nCO2 + nH2O
0,1 0,3
Ta có: 0,1. n = 0,3 ⇒ n = 3.
Vậy công thức phân tử của X là C3H6
b/ Akadien và Akin
Lý thuyết và Phương pháp giải
Phản ứng đốt cháy: CnH2n-2 + (3n - 1)/2 O2 → nCO2 + (n - 1)H2O
nCO2 > nH2O và nCO2 - nH2O = nankin.
Ví dụ minh họa
Bài 1: Hỗn hợp A gồm một anken và một ankadien có thể tích là 6,72 lít (đktc) được chia thành 2 phần bằng nhau:
- Phần 1: Đốt cháy hoàn toàn hỗn hợp thu được 8,96 lít CO2 và 6,3 gam nước.
- Phần 2: Dẫn qua dung dịch brom dư, khối lượng bình tăng m gam.
a. Tính thành phần phần trăm thể tích mỗi khí trong A?
b. Tìm khối lượng m?
c. Tìm công thức phân tử của anken và ankađien?
Bài giải:
Số mol của hỗn hợp A là: nA = 6,72/22,4 = 0,3 mol
Số mol A trong một phần là: n = 0,15 mol
Gọi công thức phân tử của anken và ankadien lần lượt là: CnH2n và CmH2m-2 (n > 1; m > 2)
Phương trình đốt cháy:
CnH2n + 3n/2 O2 → nCO2 + nH2O
CmH2m-2 + (3m-1)/2 O2 → mCO2 + (m-1) H2O
Số mol CO2 và mol H2O lần lượt là: nCO2 = 8,96/22,4 = 0,4 mol; nH2O = 6,3/18 = 0,35 mol
Số mol của ankadien là: nankaddien = 0,4 – 0,35 = 0,05 mol
Số mol của anken là: nanken = 0,15 – 0,05 = 0,1 mol
a. Phần trăm thể tích mỗi khí trong A là:
%Vanken = (0,1.100%)/0,15 = 66,67 %; %Vankaddien = 100% - 66,67% = 33,33%
b. Dẫn A qua dung dịch Brom dư thì khối lượng bình brom tăng là khối lượng của A
mA = m↑ = mC + mH = 0,4.12 + 0,35.2 = 5,5 gam
c. Theo phương trình đốt cháy ta có: 0,05m + 0,1n = 0,4 ⇒ n = 2 và m = 4
Vậy công thức phân tử của anken và ankadien là: C2H4 và C4H6
Bài 2: Đốt cháy hoàn toàn hiđrocacbon X, dẫn toàn bộ sản phẩm lần lượt đi qua bình 1 đựng H2SO4 dư, bình 2 đựng 400ml dung dịch Ca (OH)2 0,5M, không có khí đi ra khỏi bình 2. Kết thúc phản ứng thấy khối lượng bình 1 tăng lên 3,6 gam, bình 2 có 10 gam kết tủa trắng. Xác định công thức phân tử của X?
Bài giải:
Số mol Ca (OH)2 là: nCa (OH)2 = 0,5.0,4 = 0,2 mol;
Khối lượng bình 1 tăng là khối lượng của H2O: mH2O = 3,6/18 = 0,2 mol
Số mol CaCO3: nCaCO3 = 10/100 = 0,1 mol
TH1: Khí CO2 đi vào bình 2 chỉ sinh ra CaCO3:
nCO2 = nCaCO3 = 0,1 mol
nH2O > nCO2 ⇒ hidrocacbon X là ankan.
Số mol ankan là: nankan = 0,2 – 0,1 = 0,1 mol.
Phương trình đốt cháy:
CnH2n+ 2 + (3n+1)/2 O2 → nCO2 + (n+1)H2O
0,1 0,1 mol
Ta có: 0,1n = 0,1 ⇒ n =1. Vậy CTPT của X là CH4
TH2: Khí CO2 đi vào bình 2 tạo ra 2 muối là CaCO3 và Ca (HCO3)2
nCa (HCO3)2 = 0,2 – 0,1 = 0,1 mol
Theo định luật bảo toàn nguyên tố C ta có: nCO2 = 0,1.2 + 0,1 = 0,3 mol
nCO2 > nH2O ⇒ Hidrocacbon là ankin
Phương trình đốt cháy: CnH2n-2 + (3n - 1)/2 O2 → nCO2 + (n - 1)H2O
Số mol ankin là: nankin = 0,3 – 0,2 = 0,1 mol
Theo phương trình ta có: 0,1n = 0,3 ⇒ n = 3.
Vậy công thức phân tử của ankin là: C3H4
Bài 3: Đốt cháy hoàn toàn 14,6 gam hỗn hợp A (gồm 2 ankin X và Y là đồng đẳng liên tiếp, MX < MY) bằng oxi vừa đủ, hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca (OH)2 dư, thấy dung dịch thu được có khối lượng giảm đi 49 gam.
a. Xác định công thức phân tử của X?
b. Tính % số mol của X, Y trong A?
Bài giải:
a. Gọi công thức phân tử của 2 ankin là: ![]()
Ta có phương trình đốt cháy như sau:
Khối lượng dung dịch giảm 49 gam ta có: m↓ = mCaCO3 – (mH2O + mCO2)
⇒ 49 = 100. nCO2 – (18. nH2O + 44. nCO2) = 56. nCO2 – 18. nH2O (1)
Mặt khác: mA = mC + mH ⇒ 14,6 = 12. nCO2 + 2. nH2O (2)
Từ (1) và (2) ta có: nCO2 = 1,1 và nH2O = 0,7 mol
Số mol 2 ankin là: nA = 1,1 – 0,7 = 0,4 mol
Theo phương trình phản ứng: 0,4. ntb = 1,1 ⇒ ntb = 2,75
Vậy công thức phân tử của 2 ankin là: C2H2 và C3H4
b. Áp dụng sơ đồ đường chéo ta có:
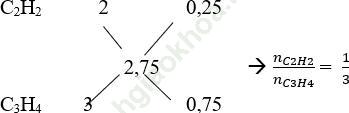
Số mol của C2H2 và C3H4 là: nC2H2 = 0,4.1/4 = 0,1 mol; nC3H4 = 0,4.3/4 = 0,3 mol
Phần trăm khối lượng của mỗi anken là:

B. Bài tập trắc nghiệm
Bài 1: Đốt cháy hoàn toàn hỗn hợp 2 olefin thu được (m + 4)g H2O và (m + 30)g CO2. Giá trị của m là:
A. 14 g B. 21 g C. 28g D. 35 g.
Đáp án: A
CnH2n + 3n/2 O2 → nCO2 + nH2O
nH2O = nCO2 ⇒ mH2O/18 = mCO2/44 ⇒ m = 14 g
Bài 2: Đốt cháy hoàn toàn a gam hỗn hợp eten, propen, but-2-en cần dùng vừa đủ b lít oxi (ở đktc) thu được 2,4 mol CO2. Giá trị của b là?
A. 92,4 lít. B. 94,2 lít. C. 80,64 lít. D. 24,9 lít.
Đáp án: C
CnH2n + 3n/2 O2 → nCO2 + nH2O
nO2 =3/2 nO2 = 3/2.2,4 = 3,6 mol
⇒ VO2 = 3,6.22,4 = 80,64 lít
Bài 3: Chia hỗn hợp 2 anken thành 2 phần bằng nhau. Đốt cháy hoàn toàn phần một trong không khí thu được 6,3 gam H2O. Phần hai cộng H2 được hỗn hợp A. Nếu đốt cháy hoàn toàn phần hai thì thể tích CO2 (đktc) tạo ra là?
A. 3,36 lít B. 7,84 lít C. 6,72 lít D. 8,96 lít
Đáp án: B
CnH2n + 3n/2 O2 → nCO2 + nH2O
CnH2n + H2 → CnH2n + 2
nCO2 = nH2O = 6,3/18 = 0,35 mol; VCO2 = 0,35.22,4 = 7,84 lít
Bài 4: Hỗn hợp X gồm C3H8 và C3H6 có tỉ khối so với hiđro là 21,8. Đốt cháy hết 5,6 lít X (đktc) thì thu được bao nhiêu gam CO2 và bao nhiêu gam H2O?
A. 33g và 17,1g. B. 22g và 9,9g.
C. 13,2g và 7,2g. D. 33g và 21,6g.
Đáp án: A
C3H6 + 9/2 O2 → 3CO2 + 3H2O
C3H8 + 5O2 → 3CO2 + 4H2O
nX = 0,25 mol ⇒ nCO2 = 0,25.3 = 0,75 mol; mCO2 = 0,75.44 = 33 gam;
mX = mC + mH ⇔ 21,8.2.0,25 = 0,75.12 + 2. nH2O
⇒ nH2O = 0,95mol; mH2O = 18.0,95 = 17,1 gam
Bài 5: Một hỗn hợp A gồm 2 hiđrocacbon X, Y liên tiếp nhau trong cùng dãy đồng đẳng. Đốt cháy 11,2 lít hỗn hợp X thu được 57,2 gam CO2 và 23,4 gam H2O. Công thức phân tử X, Y và khối lượng của X, Y là?
A. 12,6 gam C3H6 và 11,2 gam C4H8.
B. 8,6 gam C3H6và 11,2 gam C4H8.
C. 5,6 gam C2H4 và 12,6 gam C3H6.
D. 2,8 gam C2H4 và 16,8 gam C3H6.
Đáp án: C
nCO2 = 1,3 mol; nH2O = 1,3 mol ⇒ Hidrocacbon là anken; Công thức phân tử là:
CnH2n + 3n/2 O2 → nCO2 + nH2O
nX = 0,5 mol ⇒ ntb = 1,3/0,5 = 2,6
⇒ 2 anken là: C2H4, C3H6;
nC2H4: nC3H6 = 2: 3 ⇒ nC2H4 = 0,2 mol và nC3H6 = 0,3 mol
⇒ mC2H4 = 0,2.28 = 5,6 gam và mC3H6 = 0,3.42 = 12,6 gam
Bài 6: Đốt cháy hoàn toàn 0,2 mol hồn hợp X gồm một ankan và một anken, thu được 0,35 mol CO2 và 0,4 mol H2O. Thành phần phần trăm số mol của anken có trong X là?
A.40% B. 50% C. 25% D. 75%
Đáp án: D
CnH2n + 3n/2 O2 → nCO2 + nH2O
CnH2n+2 + (3n+1)/2 O2 → nCO2 + (n+1)H2O
nankan = nH2O - nCO2 = 0,4 – 0,35 = 0,05 (mol)
nanken = 0,2 – 0,05 = 0,15 mol
→ %Vanken =. 100% = 75%
Bài 7: Đốt cháy hoàn toàn 0,1 mol hỗm hợp gồm CH4, C4H10 và C2H4 thu được 0,14 mol CO2 và 0,23 mol H2O. Số mol của ankan và anken trong hỗn hợp lần lượt là?
A. 0,09 và 0,01. B. 0,01 và 0,09.
C. 0,08 và 0,02 D. 0,07 và 0,04
Đáp án: A
CnH2n + 3n/2 O2 → nCO2 + nH2O
CnH2n+2 + (3n+1)/2 O2 → nCO2 + (n+1) H2O → nankan = 0,23 – 0,14 = 0,09 mol
⇒ nanken = 0,1 – 0,09 = 0,01 mol
Bài 8: Đốt cháy hoàn toàn 2,7 gam ankađien liên hợp X, thu được 4,48 lít CO2 (đktc). Công thức cấu tạo của X là?
A. CH2 = C = CH2 B. CH2 = C – CH = CH2.
C. CH2 = C (CH3) – CH = CH2 D. CH2 = CH – CH = CH2
Đáp án: D
Đặt Công thức phân tử X là CnH2n-2
Công thức phân tử của X là: C4H6
Công thức cấu tạo là CH2 = CH – CH = CH2
Bài 9: Đốt cháy hoàn toàn 2,24 lít khí X (đktc) gồm buta–1,3–đien và etan sau đó dẫn toàn bộ sản phẩm cháy hấp thụ vào dung dịch H2SO4 đặc thì khối lượng dung dịch axit tăng thêm bao nhiêu gam?
A. 3,6 g. B. 5,4 g. C. 9,0 g. D. 10,8 g.
Đáp án: B
nH2O = 3. nX = 3.0,1 = 0,3 mol ⇒ m↑ = mH2O = 0,3.18 = 5,4 gam
Bài 10: 2,24 lít hỗn hợp X gồm buta–1,3–đien và penta–1–3-đien (đktc) có thể tác dụng hết tối đa bao nhiêu lít dung dịch brom 0,10 M?
A. 2 lít. B. 1 lít. C. 1,5 lít. D. 2,5 lít.
Đáp án: A
nBr2 = 2nX = 0,2 mol ⇒ VBr2 = 0,2/0,1 = 2 lít
Bài 11: Đốt cháy 8 gam ankin X, rồi hấp thụ hoàn toàn sản phẩm cháy vào dd Ca (OH)2 dư, thu được 60 gam kết tủa. Công thức phân tử của X là:
A. C2H2 B. C3H4 C. C5H8 D. C4H6
Đáp án: B
CnH2n-2 + (3n-1)/2 O2 → nCO2 + (n-1)H2O
nCO2 = nCaCO3 = 0,6 mol ⇒ MX = 8n/0,6 = 40n/3 ⇒ n = 3
Bài 12: Đốt cháy hoàn toàn 1 thể tích A gồm C2H6 và C2H2 thu được CO2 và H2O có tỉ lệ mol là 1: 1. Phần trăm thể tích mỗi khí trong hỗn hợp đầu lần lượt là?
A. 50%, 50% B. 30%, 70% C. 25%, 75% D. 70%, 30%
Đáp án: A
giả sử nA = 1 mol; nC2H6 = x và nC2H2 = y; nH2O = nCO2 = 2 mol; x + y = 1 và 3x + y = 2 ⇒ x = 0,5 và y = 0,5
⇒ %V là 50%, 50%
Bài 13: 1 mol hiđrocacbon X đốt cháy cho ra 5 mol CO2, 1mol X phản ứng với 2 mol AgNO3/NH3. Xác định công thức cấu tạo của X?
A. CH2=CH-CH2-C≡ C-H C. CH2=CH-CH=CH-CH3
B. HC≡ C-CH2- C≡ C-H D. CH2=C=CH-CH-CH2
Đáp án: B
Công thức phân tử của X là CxHy; x= 5
⇒ có 5 nguyên tử C; X có 2 liên kết 3 ở đầu mạch.
Bài 14: Đốt cháy hoàn toàn m gam hiđrocacbon ở thể khí, mạch hở, nhẹ hơn không khí thu được 7,04 gam CO2. Sục m gam hiđrocacbon này vào nước brom dư đến khi phản ứng hoàn toàn, thấy có 25,6 gam brom phản ứng. Giá trị của m là?
A. 2 gam. B. 4 gam. C. 10 gam D. 2,08 gam
Đáp án: D
Hidrocacbon là C2H2 (vì M < Mkk; nBr2 = 2nankin)
nBr2 = 0,16 mol; nCO2 = 0,16 mol; nankin = 0,08 mol; m = 0,08.26 = 2,08 gam.
Bài 15: Hỗn hợp X có tỉ khối so với H2 là 21 gồm propan, propen và propin. Khi đốt cháy hoàn toàn 0,1 mol X, tổng khối lượng của CO2 và H2O thu được là?
A. 18,60 gam. B. 18,96 gam. C. 20,40 gam. D. 16,80 gam.
Đáp án: A
nCO2 = 3nX = 3.0,1 = 0,3 mol; mX = 0,1.21.2 = 4,2 gam
⇒ nH2O = (4,2 – 0,3.12)/2 = 0,3 mol;
m = mCO2 + mH2O = 0,3.44 + 0,3.18 = 18,6 gam