4 dạng bài tập về Hidrocacbon không no trong đề thi Đại học có giải chi tiết - Chuyên đề Hóa 11
Hiđrocacbon không no gồm:
+ Anken: CnH2n (n ≥ 2)
+ Ankin: CnH2n-2 (n ≥ 2)
+ Ankađien: CnH2n-2 (n ≥ 3)
Dạng 1: Phản ứng cộng (H2, Br2,... )
Phương pháp
+ Anken chứa 1 liên kết ℼ ⇒ nanken: nH2 (nBr2) = 1: 1
+ Ankin chứa 2 liên kết ℼ ⇒ nankin: nH2(nBr2) = 1: 2
+ Sử dụng phương pháp bảo toàn liên kết:
nliên kết ℼ = nH2 (nBr2)
+ Sử dụng phương pháp bảo toàn khối lượng:
mtrước = msau ⇒ 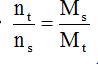
+ nkhí giảm = nH2 pư = nanken pư = nankan sinh ra
Ví dụ minh họa
Ví dụ 1: Cho hỗn hợp X gồm 2 olefin qua bình đựng dung dịch brom, khi phản ứng xong có 16g brom tham gia phản ứng. Tổng số mol của 2 anken là?
A. 0,01. B. 0,5. C. 0,05. D. 0,1.
Bài giải:
Ta có: nanken = nBr2 phản ứng = 0,1
⇒ Đáp án đúng là: D.
Ví dụ 2: Cho hỗn hợp X gồm 1 anken và H2 tỉ khối hơi so với He =3,33. Cho X qua Ni nung nóng, đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp khí Y có tỉ khối hơi so với He = 4. Tìm công thức phân tử của anken.
A. C2H4 B. C3H6 C. C4H8 D. C5H10
Bài giải:
Ta có: MX = 3,33.4 = 13,32; MY = 4.4 = 16
MY = 16 ⇒ Trong hỗn hợp Y có H2, anken phản ứng hết H2 dư
Áp dụng định luật bảo toàn khối lượng ta có: mX = mY
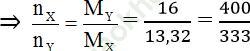
Giả sử: nX = 400 mol; nY = 333 mol
nanken pư = nX - nY = 400 - 333 = 67 (mol)
nH2(X) = 400 – 67 = 333 mol
Ta có sơ đồ đường chéo:
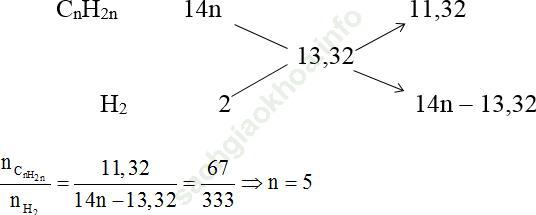
Công thức phân tử anken là: C5H10
⇒ Đáp án đúng là: D
Ví dụ 3: Hỗn hợp khí X gồm 0,3 mol H2 và 0,1 mol vinylaxetilen. Nung X một thời gian với xúc tác Ni thu được hỗn hợp khí Y có tỉ khối so với không khí là 1. Nếu cho toàn bộ Y sục từ từ vào dung dịch brom (dư) thì có m gam brom tham gia phản ứng. Giá trị của m là?
A. 32,0 B. 8,0 C. 3,2 D. 16,0
Bài giải:
Vinylaxetilen: phân tử có 3 liên kết ℼ
nℼ = 3.0,1 = 0,3 mol; nX = 0,3 + 0,1 = 0,4 mol.
mX = 0,3.2 + 0,1.52 = 5,8 gam = mY
MY = 29 ⇒ n Y = 0,2 mol
nH2 phản ứng = nkhí giảm = nX – nY = 0,4 – 0,2 = 0,2 mol.
Bảo toàn liên kết: nℼ = nH2 pư + nBr2 = 0,3 mol
⇒ nBr2 = 0,3 – 0,2 = 0,1mol
⇒ Đáp án đúng là: D.
Ví dụ 4: Đun nóng hỗn hợp khí X gồm 0,06 mol C2H2, 0,05 mol C3H6 và 0,07 mol H2 với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y gồm C2H6, C2H4, C3H8, C2H2 dư, C3H6 dư và H2 dư. Đốt cháy hoàn toàn hỗn hợp Y rồi cho sản phẩm hấp thụ hết vào dung dịch nước vôi trong dư. Khối lượng bình dung dịch nặng thêm là?
A. 5,04 gam. B. 11,88 gam. C. 16,92 gam. D. 6,84 gam.
Bài giải:
Đốt Y cũng bằng đốt cháy X, ta có:
C2H2 → 2CO2 + H2O
0,06 → 0,12 0,06 (mol)
C3H6 → 3CO2 + 3H2O
0,05 → 0,15 0,15 (mol)
H2 → H2O
0,07 → 0,07 (mol)
Khối lượng bình tăng bằng khối lượng CO2 và khối lượng H2O.
⇒ mbình tăng = (0,12 + 0,15).44 + (0,06 + 0,15 + 0,07).18 = 16,92g
⇒ Đáp án đúng là: C.
Ví dụ 5: Đun nóng hỗn hợp khí X gồm 0,06 mol C2H2 và 0,04 mol H2 với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y. Dẫn toàn bộ hỗn hợp Y từ từ qua bình đựng Br2 dư thì còn lại 0,448l hỗn hợp khí Z (đktc) có tỉ khối so với O2 là 0,5. Khối lượng bình dung dịch Br2 tăng là?
A. 1,2g B. 1,04g C. 1,64g D. 1,32g
Bài giải:
Ta có: nZ = 0,02 mol; MZ = 16
⇒ mZ = 0,32g
Theo định luật bảo toàn khối lượng, ta có:
mX = mY = 0,06.26 + 0,04.2 = 1,64g.
Áp dụng định luật bảo toàn khối lượng, ta có:
mX = mY + mkhí bị hấp thụ ở bình Br2
⇒ mbình brom tăng = mx – mz = 1,64 - 0,32 = 1,32 g.
⇒ Đáp án đúng là: D.
Ví dụ 6: Hỗn hợp X gồm H2 và C3H6 có tỉ khối so với He bằng 5,5. Cho X qua xúc tác Ni, nung nóng thu được hỗn hợp Y có tỉ khối so với He bằng 6,875. Hiệu suất phản ứng hiđro hóa anken là?
A. 30%. B. 20%. C. 50%. D. 40%.
Bài giải:
Giả sử có nX = 1⇒ mX = 1.5,5.4 = 22g
Sử dụng sơ đồ đường chéo ⇒ nH2 = nC3H6 = 0,5 mol.
Bảo toàn khối lượng: mY = mX = 22 (g) ⇒ nY = 22: 27,5 = 0,8 mol.
⇒ nC3H6 phản ứng = nkhí giảm = nX – nY = 0,2 mol
H% = 0,2/0,5× 100% = 40%
⇒ Đáp án đúng là: D
Dạng 2: Phản ứng đốt cháy
Phương pháp
+ Đốt cháy anken: nH2O = nCO2
+ Đốt cháy ankin: nCO2 – nH2O = nankin
Ví dụ minh họa
Ví dụ 1: Đốt cháy hoàn toàn hỗn hợp X gồm etan và etilen, thu được 3,36 lít CO2 (đktc) và 3,60 gam H2O. % thể tích mỗi khí trong hỗn hợp X là?
A. C2H6: 50%; C2H4: 50% B. C2H6: 60%; C2H4: 40%
C. C2H6: 66,7%; C2H4: 33,3% D. C2H6: 75%; C2H4: 25%
Bài giải:
nCO2 = 0,15 mol; nH2O = 0,2 mol.
Ta có: nH2O – nCO2 = nankan = nC2H6 = 0,05 mol;
Theo định luật bảo toàn C ta có: nCO2 = 2nC2H6 + 2nC2H4 ⇒ nC2H4 = 0,025 mol
%VC2H6 = 0,05/ (0,05+0,025).100% = 66,7%
⇒%VC2H4 = 33,3%
⇒ Đáp án đúng là: C
Ví dụ 2: Đốt cháy hoàn toàn 2 hiđrocacbon mạch hở liên tiếp nhau trong dãy đồng đẳng. Sản phẩm cháy lần lượt cho qua bình 1 đựng H2SO4 đặc và bình 2 đựng KOH đặc, dư thấy khối lượng bình 1 tăng 2,7 gam và bình 2 tăng 11 gam. Hai hiđrocacbon đó là?
A. C2H2; C3H4. B. C2H4; C3H6. C. C2H6; C3H8. D. C3H4; C4H6.
Bài giải:
Bình 1 tăng 2,7g ⇒ nH2O = 0,15 mol.
Bình 2 tăng 11 gam ⇒ nCO2 = 0,25 mol.
Ta thấy: nH2O < nCO2 ⇒ 2 CxHy thuộc dãy đồng đẳng của ankin hoặc ankađien (CnH2n-2).
⇒ nCnH2n-2= nCO2 – nH2O = 0,1 mol
⇒ Ctrung bình = nCO2: nCnH2n-2 = 0,25: 0,1 = 2,5 ⇒ C2H2 và C3H4
⇒ Đáp án đúng là: A
Ví dụ 3: Dẫn 2,8 lít hỗn hợp khí X gồm hai hiđrocacbon mạch hở vào bình đựng dung dịch brom (dư). Sau khi phản ứng xảy ra hoàn toàn, có 16 gam brom đã phản ứng và còn lại 1,68 lít khí thoát ra. Nếu đốt cháy hoàn toàn 2,8 lít X thì sinh ra 5,04 lít khí CO2 (các thể tích khí đều đo ở đktc). Công thức phân tử của hai hiđrocacbon trong hỗn hợp X là?
A. CH4 và C3H6. B. C2H6 và C3H4.
C. CH4 và C4H6. D. CH4 và C3H4.
Bài giải:
Ta có: nX = 0,125 mol
X đi qua dung dịch brom thu được 1,68 lít khí ⇒ X có ankan
nCnH2n + 2 = 1,68: 22,4 = 0,075 mol ⇒ nCxHy= 0,05 mol
nCO2 = 0,225 mol
Số C trung bình = 0,225: 0,125 ≈ 1,8 ⇒ Ankan là CH4.
Ta có: nCO2 = 0,075 + 0,05m = 0,225 ⇒ m = 3
nBr2 = 16: 160 = 0,1 mol = 2nCxHy
⇒ CxHy còn lại có 2 liên kết ℼ (CmH2m–2) ⇒ C3H4
⇒ Đáp án đúng là: D
Dạng 3: Phản ứng trùng hợp của anken, ankađien
Phương pháp:
Tất cả các hợp chất có chứa liên kết đôi có thể tham gia phản ứng trùng hợp.
Ví dụ minh họa
Ví dụ 1: Cho sơ đồ tổng hợp poli vinylclorua PVC như sau:
Để tổng hợp 1 tấn PVC thì cần bao nhiêu m3 khí thiên nhiên (chứa 95% metan) ở đktc?
A. 5883 B. 5888 C. 5683 D. 5970
Bài giải:
Ta có: Hchung = 15%. 95%. 90% = 12,825%
Sơ đồ điều chế:

VCH4 = 3,992.1000/16.22,4 = 5889m3
⇒ Vkhí thiên nhiên = 5889: 95% = 5883m3
⇒ Đáp án đúng là: A
Ví dụ 2: Từ 4 tấn C2H4 có chứa 30% tạp chất có thể điều chế bao nhiêu tấn PE? (Biết hiệu suất phản ứng là 90%).
A. 2,55 B. 2,8 C. 2,52 D. 3,6
Bài giải:
nC2H4 → (- CH2 –CH2)n
metylen = 4.70% = 2,8 tấn
⇒ mPE thu được = 2,8.0,9 = 2,52 tấn
⇒ Đáp án đúng là: C
Ví dụ 3: Người ta sản xuất cao su Buna từ gỗ theo sơ đồ sau: (trong ngoặc là hiệu suất phản ứng của mỗi phương trình).
Tính lượng gỗ cần thiết để sản xuất được 1 tấn cao su, giả sử trong gỗ chứa 50% xenlulozơ?
A. 35,714 tấn. B. 17,857 tấn. C. 8,929 tấn. D. 18,365 tấn.
Bài giải:
Hchung = 35%. 80%. 60%. 100% = 16,8%

mgỗ = 17,857: 50% = 35,714 tấn
⇒ Đáp án đúng là: A
Dạng 4: Phản ứng thế ankin - 1
Phương pháp:
Nhưng ankin có liên kết 3 đầu mạch (ankin -1) sẽ tham gia phản ứng thế Ag với AgNO3/NH3
PTTQ:
Lưu ý: Với axetilen phản ứng thế Ag theo tỉ lệ 1: 2 tạo ra C2Ag2
Ví dụ minh họa
Ví dụ 1: Nung 896 ml C2H2 và 1,12 lít H2 (đktc) với Ni (với hiệu suất H = 100%) được hỗn hợp X gồm 3 chất. Dẫn X qua dung dịch AgNO3 trong NH3 dư, được 2,4 gam kết tủa. Số mol của phân tử khối lớn nhất trong X là?
A. 0,01 mol. B. 0,03 mol. C. 0,02 mol. D. 0,015 mol.
Bài giải:
nC2H2 = 0,04 mol; nH2 = 0,05 mol
Hỗn hợp X gồm: C2H6, C2H4 và C2H2.
Với nC2H2 dư = nC2Ag2 = 2,4/240 = 0,01 mol.
+ Đặt nC2H6 = a và nC2H4 = b, ta có:
Bảo toàn số mol H2 đã phản ứng:
nH2 = 2nC2H6 + 2nC2H4 = 2a + b = 0,05 (1).
Theo định luật bảo toàn cacbon ta có:
2nC2H2 = 2 (nC2H6 + nC2H4 + nC2H2 dư)
⇒ a + b = 0,04 – 0,01 = 0,03 (2).
Từ (1)(2) ⇒ nC2H6 = a = 0,02 mol
⇒ Đáp án đúng là: C
Ví dụ 2: Hỗn hợp khí X gồm etilen và propin. Cho a mol X tác dụng với lượng dư dung dịch AgNO3 trong NH3 thu được 22,05 gam kết tủa. Mặt khác a mol X phản ứng tối đa với 0,40 mol H2. Giá trị của a là?
A. 0,40. B. 0,35. C. 0,55. D. 0,25.
Bài giải:
nC2H4 = x và nC3H4 = y.
nH2 = x +2y = 0,4 (1).
m↓ = 147y = 22,05 (2).
Từ (1) và (2) ⇒ x = 0,1 và y = 0,15
⇒ a = x + y = 0,25
⇒ Đáp án đúng là: D
Ví dụ 3: Cho 7,8 gam axetilen vào nước có xúc tác H2SO4 ở 80oC, hiệu suất phản ứng này là H%. Cho toàn bộ hỗn hợp thu được sau phản ứng vào dung dịch AgNO3 dư trong NH3 thì thu được 66,96 gam kết tủa. Giá trị H là?
A. 30%. B. 70%. C. 93%. D. 73%.
Bài giải:
C2H2 + H2O 80oC→ CH3CHO.
Đặt nC2H2 phản ứng = x; nC2H2 dư = y.
⇒ nC2H2 ban đầu = x + y = 0,3 mol (1)
Kết tủa gồm x mol C2Ag2 và 2y mol Ag.
⇒ m↓ = 240x + 108 × 2y = 66,96 (g) (2)
⇒ Từ (1) và (2) ⇒ x = 0,09 mol; y = 0,21 mol.
H% = 0,21/0,3× 100% = 70%
⇒ Đáp án đúng là: B