Dạng 5: Phản ứng oxi hóa Anken, Ankađien, Ankin - Chuyên đề Hóa 11
A. Phương pháp giải & Ví dụ minh họa

* Tỷ lệ: nAnken: = 3: 2 và luôn không đổi
n R1 – CH =CH – R2 → Viết phương trình chỉ quan tâm nguyên tử C mang liên kết đôi
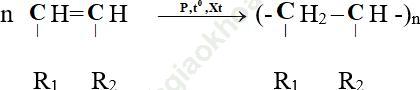
Tính tỷ lệ mắt xích: n = Mpolyme/Manken
Ví dụ minh họa
Bài 1: Để khử hoàn toàn 200 ml dung dịch KMnO4 0,2M tạo thành chất rắn màu đen cần V lít khí C2H4 (đktc). Giá trị tối thiểu của V là?
Bài giải:
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2 + 2KOH
⇒ V = 0,06.22,4 = 1,344 (lít)
Bài 2: Cho 3,5g một anken tác dụng với dung dịch KMnO4 loãng thì được 5,2g sản phẩm hữu cơ. Tìm công thức phân tử của anken.
Bài giải:
Gọi công thức phân tử của anken là: CnH2n
Ta có phương trình phản ứng như sau:
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n+2O2 + 2MnO2 + 2KOH
3.14n 3.14n + 102 M↑ = 102 g/mol
3,5 5,2 m↑ = 1,7 gam
n↑ = 1,7/102 = 1/60 ⇒ nanken = 0,05 mol
Manken = 3,5/0,05 = 70 = 14n ⇒ n = 5
Vậy công thức phân tử của anken là: C5H10
Bài 3: Một hỗn A hợp hai olefin đồng đẳng kế tiếp nhau có thể tích 44,8 lít (đktc) dẫn qua bình chứa dung dịch KMnO4 dư, thấy khối lượng bình chứa dung dịch KMnO4 tăng 70g.
1. Xác định công thức phân tử, viết công thức cấu tạo hai olefin.
2. Sau khi phản ứng xảy ra thu được m gam kết tủa. Tính m?
Bài giải:
Số mol hỗn hợp 2 anken: nA = 44,8/22,4 = 2 mol
Phương trình phản ứng:
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n+2O2 + 2MnO2 ↓ + 2KOH
1. Khối lượng bình KMnO4 tăng là khối lượng của 2 anken:
Manken = 70 gam ⇒ MA = 70/2 = 35
⇒ ntb = 35/14 = 2,5
Vậy công thức phân tử của 2 anken là: C2H4 và C3H6
2. Theo phương trình phản ứng ta có: nMnO2 = 2.2/3 = 4/3 mol
Vậy khối lượng kết tủa thu được là: m = 84.4/3 = 112 gam
B. Bài tập trắc nghiệm
Bài 1: Oxi hoá etilen bằng dung dịch KMnO4 thu được sản phẩm là:
A. MnO2, C2H4(OH)2, KOH.
B. C2H5OH, MnO2, KOH.
C. K2CO3, H2O, MnO2.
D. C2H4(OH)2, K2CO3, MnO2.
Đáp án: A
3C2H4 + 2KMnO4 + 4H2O → 3C2H6O2 + 2MnO2 ↓ + 2KOH
Bài 2: Để khử hoàn toàn 200 ml dung dịch KMnO4 0,2M tạo thành chất rắn màu nâu đen cần V lít khí C2H4 (ở đktc). Giá trị tối thiểu của V là?
A. 2,240. B. 2,688. C. 4,480. D. 1,344.
Đáp án: D
3C2H4 + 2KMnO4 + 4H2O → 3C2H6O2 + 2MnO2 ↓ + 2KOH
nKMnO4 = 0,2.0,2 = 0,04 mol; nC2H4 = 0,04.3/2 = 0,06 mol
⇒ VC2H4 = 0,06.22,4 = 1,344 lít
Bài 3: Anken A phản ứng hoàn toàn với dung dịch KMnO4 được chất hữu cơ B có MB = 1,81MA. Công thức phân tử của A là?
A. C2H4 B. C3H6 C. C4H8 D. C5H10
Đáp án: B
Công thức phân tử của anken A: CnH2n; chất hữu cơ B: CnH2n+2O2;
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n+2O2 + 2MnO2 ↓ + 2KOH
MB = 1,81; MA ⇔ 14n + 34 = 1,81.14n ⇒ n = 3
Bài 4: Hiện nay PVC được điều chế theo sơ đồ sau:
C2H4 → CH2Cl–CH2Cl → C2H3Cl → PVC.
Nếu hiệu suất toàn bộ quá trình đạt 80% thì lượng C2H4 cần dùng để sản xuất 5000kg PVC là?
A. 280kg. B. 1792kg. C. 2800kg. D. 179,2kg.
Đáp án: C
nPVC = 5000/62,5 = 80 kmol ⇒ mC2H4 = 80.100.28/80 = 2800kg
Bài 5: Thổi 0,25 mol khí etilen qua 125ml dung dịch KMnO4 1M trong môi trường trung tính (hiệu suất 100%) khối lượng etylenglicol thu được bằng?
A. 11,625g. B. 23,25g. C. 15,5g. D. 31g.
Đáp án: A
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n+2O2 + 2MnO2 ↓ + 2KOH
netilenglicol = 0,125.3/2 = 0,1875 mol ⇒ m = 0,1875.62 = 11,625 gam
Bài 6: Dẫn propen vào dung dịch KMnO4 thu được sản phẩm hữu cơ là?
A. CH3CH2CH2CH3 B. CH3CH (OH)CH3.
C. CH3CH=CHCH3 D.CH3CH (OH)CH2OH
Đáp án: D
Bài 7: Chất nào sau đây không làm đổi màu dung dịch KMnO4 ở nhiệt độ thường?
A. Axetilen B. Toluen C. Propilen D. Striren
Đáp án: B