Bài 9: Khái quát về nhóm nitơ - Giải BT Hóa học 11 nâng cao
Bài 9: Khái quát về nhóm nitơ
Bài 1 (trang 36 sgk Hóa 11 nâng cao): Viết cấu hình electron nguyên tử của các nguyên tố asen, antimon và bitmut ở trạng thái cơ bản và trạng thái kích thích.
Bài giải:- Cấu hình electron của As (Z = 33): [Ar] 3d104s24p3
Ở trạng thái kích thích: [Ar] 3d104s14p3d1
- Cấu hình electron của Sb (Z = 51): [Kr]4d105s25p3
Ở trạng thái kích thích: [Kr]4d105s15p35d1
- Cấu hình electron của Bi (Z = 83): [Xe]4f145d106s26p3
Ở trạng thái kích thích: [Xe]4f145d106s16p36d1
Bài 2 (trang 36 sgk Hóa 11 nâng cao): Dựa vào độ âm điện của các nguyên tố, giải thích:
a) Vì sao từ nitơ đến bitmut tính phi kim của các nguyên tố giảm dần?
b) Vì sao tính phi kim của nitơ yếu hơn so với oxi và càng yếu hơn so với flo?a) Trong nhóm VA đi từ N đến Bi độ âm điện giảm ⇒ Tính phi kim giảm vì độ âm điện đặc trưng cho tính phi kim.
b) Các nguyên tố N, O và F thuộc chu kì 2 của bảng tuần hoàn. Theo quy luật của một chu kì, theo chiều tăng của điện tích hạt nhân độ âm điện tăng, tính phi kim tăng.
Vì vậy tính phi kim: 7N < 8O < 9F.
Bài 3 (trang 36 sgk Hóa 11 nâng cao): Nêu một số hợp chất trong đố nitơ và photpho có số oxi hóa -3, +3, +5.
Bài giải: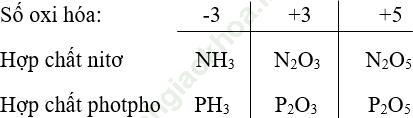
Bài 4 (trang 36 sgk Hóa 11 nâng cao): Vì sao trong các hợp chất nitơ chỉ có hóa trị tối đa là 4, trong khi đối với các nguyên tố còn lại hóa trị tối đa của chúng là 5?
Bài giải:Nguyên tử nitơ không có obitan d trống, nên ở rạng thái kích thích không xuất hiện 5 electron độc thân để tạo thành 5 liên kết cộng hóa trị. Ngoài khả năng tạo 3 liên kết cộng hóa trị bằng sự góp chung electron, nitơ còn có khả năng tạo thêm 1 liên kết cho – nhận. Các nguyên tố còn lại của nhóm VA khi ở trạng thái kích thích nguyên tử của chúng xuất hiện 5 electron độc thân nên có khả năng tạo 5 liên kết cộng hóa trị.
Bài 5 (trang 36 sgk Hóa 11 nâng cao): Lập các phương trình hóa học sau và cho biết As, Bi và Sb2O3 thể hiện tính chất gì?
a) As + HNO3 → H3ASO4 + H2O
b) Bi + HNO3 → Bi (NO3)3+ NO + H2O
c) Sb2O3 + HCl → SbCl3 + H2O
d) Sb2O3 + NaOH → NaSbO2 + H2O
Bài giải:
c) Sb2O3 + 6HCl → 2SbCl3 + 3H2O (Sb2O3 đóng vai trò bazơ)
d) Sb2O3 + 2NaOH → 2NaSbO2 + H2O (Sb2O3 đóng vai trò axit)
Vậy Sb2O3 là hợp chất lưỡng tính.