Bài 2: Phân loại các chất điện li
Bài 2: Phân loại các chất điện li
Bài 1 (trang 10 sgk Hóa 11 nâng cao): Độ điện li là gì? Thế nào là chất điện li mạnh, chất điện li yếu? Lấy một số thí dụ chất điện li mạnh, chất điện li yếu và viết phương trình điện li của chúng.
Bài giải:Khái niệm:
- Độ điện li của một chất là tỉ số phân tử chất tan đã điện li và số phân tử chất tan ban đầu.
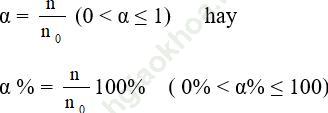
* Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion.
+ Chất điện li mạnh có α = 1 hoặc α % = 100%, gồm có:
- Các axit mạnh: HCl, HBr, HI, HNO3, HClO4, H2SO4,…
HCl → H+ + Cl-;
HNO3 → H+ + NO3-
- Các bazơ mạnh: KOH, NaOH, Ba (OH)2,…
NaOH → Na+ + OH-
Ba (OH)2 → Ba2+ + 2OH-
- Các muối tan: NaCl, K2SO4, Ba (NO3)2,…
K2SO4 → 2K+ + SO42-;
Ba (NO3)2→ Ba2+ + 2NO3-
* Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
+ Chất điện li yếu có α < 1 hoặc α % < 100%, gồm có:
- Các axit yếu: HF, H2CO3, H2SO3, H2S, H3PO4, CH3COOH, …
CH3COOH ↔ CH3COO- + H+
- Các bazơ yếu: NH3, Al (OH)3, Zn (OH)2, Mg (OH)2,…
Zn (OH)2 ↔ Zn2+ + 2OH-
Bài 2 (trang 10 sgk Hóa 11 nâng cao): Chất điện li mạnh có độ điện li
A. α = 0.
B. α = 1.
C. α < 1.
D. 0 < α < 1.
Bài giải:Đáp án đúng: B.
Chất điện li mạnh có độ điện li α = 1.
Bài 3 (trang 10 sgk Hóa 11 nâng cao): Chất điện li yếu có độ điện li.
A. α = 0.
B. α = 1.
C. 0 < α < 1.
D. α < 0.
Bài giải:Đáp án đúng: C.
Chất điện li yếu có độ điện li 0 < α < 1.
Bài 4 (trang 10 sgk Hóa 11 nâng cao): NaF là chất điện li mạnh, HF là chất điện li yếu. Bằng phương pháp thực nghiệm nào có thể phân biệt được chúng? Mô tả phương pháp đó.
Bài giải:Lấy hai cốc đựng hai dung dịch trên có cùng nồng độ lắp vào bộ dụng cụ chứng minh tính dẫn điện của dung dịch (hình 1.1) SGK, nối các đầu dây dẫn điện với cùng nguồn điện bóng đèn ở cốc nào cháy sáng hơn là NaF (NaF là chất điện li mạnh); bóng đèn ở cốc nào cháy yếu hơn là HF (HF là chất điện li yếu).
Bài 5 (trang 10 sgk Hóa 11 nâng cao): Tính nồng độ mol của cation và anion trong các dung dịch sau:
a) Ba (NO3)20,10M.
b) HNO3 0,020M.
c) KOH 0,010M.
Bài giải:a) Ba (NO3)2→ Ba2+ + 2NO3-
0,1M → 0,1M → 0,2M
b) HNO3 → H+ + NO3-
0,02M → 0,02M → 0,02M
c) KOH → K+ + OH-
0,01M → 0,01M → 0,01M
Bài 6 (trang 10 sgk Hóa 11 nâng cao):
a) Chứng minh rằng độ điện li có thể tính bằng công thức sau:
Trong đó C0 là nồng độ mol của chất hòa tan, C là nồng độ mol của chất hòa tan phân li ra ion.
b) Tính nồng độ mol của CH3COOH, CH3COO- và H+ trong dung dịch CH3COOH 0,043M, biết rằng nồng độ điện li α của CH3COOH bằng 20%.
Bài giải:a) Giả sử dung dịch chất điện li yếu có thể tích là V lít
Số phân tử hòa tan là n0, số phân tử phân li thành ion là n.
b) CH3COOH ↔ CH3COO- + H+
Áp dụng CT (1) ⇒ C = α. C0 = 0,043.20% = 8,6.10-4 mol/lit
⇒ [CH3COO-] = [H+] = 8,6.10-4 mol/lít.
[CH3COOH]sau pư = 0,043 – 8,6.10-4 = 0,04214 mol/lit
Bài 7 (trang 10 sgk Hóa 11 nâng cao): Cân bằng sau tồn tại trong dung dịch: CH3COOH ↔ H+ + CH3COO-
Độ điện li α của CH3COOH sẽ biến đổi như thế nào?
a) Khi nhỏ vào vài giọt dung dịch HCl.
b) Khi pha loãng dung dịch.
c) Khi nhỏ vào vài giọt dung dịch NaOH.
Bài giải:Xét cân bằng: CH3COOH ↔ H+ + CH3COO-
a) Khi thêm HCl nồng độ [H+] tăng ⇒ cân bằng dịch chuyển theo chiều nghịch tạo CH3COOH ⇒ số mol H+ và CH3COO- điện li ra ít ⇒ α giảm.
b) Khi pha loãng dung dịch, các ion dương và ion âm ở cách xa nhau hơn ít có điều kiện để va chạm vào nhau để tạo lại phân tử ⇒ α tăng.
Như vậy, V tăng ⇒ C = n/V giảm và KA không đổi
⇒ KA/C tăng ⇒ α tăng.
c) Khi nhỏ vào vài giọt dung dịch NaOH, ion OH- điện li ra từ NaOH sẽ lấy H+:
H+ + OH- → H2O, làm nồng độ H+ gảm ⇒ cân bằng dịch chuyển theo chiều thuận ⇒ số mol H+ và CH3COO- điện li ra nhiều ⇒ α tăng.
Bài trước: Bài 1: Sự điện li - Giải BT Hóa học 11 nâng cao Bài tiếp: Bài 3: Axit, bazơ và muối