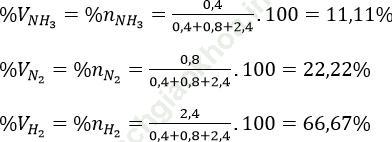Bài 13: Luyện tập Tính chất của nitơ và hợp chất của nitơ - Giải BT Hóa học 11 nâng cao
Bài 13: Luyện tập Tính chất của nitơ và hợp chất của nitơ
Bài 1 (trang 57 sgk Hóa 11 nâng cao): Viết các Phương trình phản ứng hóa học để thực hiện các dãy chuyển hóa sau.
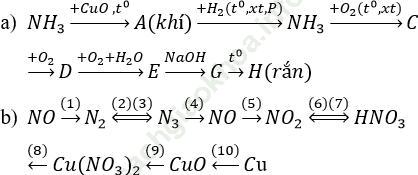
Bài giải:

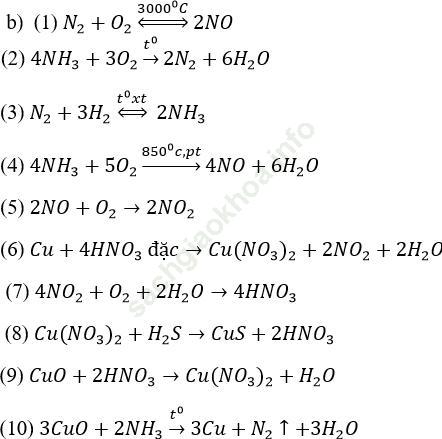
Bài 2 (trang 58 sgk Hóa 11 nâng cao): Chất khí A có mùi khai, phản ứng với khí clo theo cách khác nhau sau đây, tùy theo điều kiện phản ứng.
Trong trường hợp dư khí A thì xảy ra phản ứng:
8A + 3Cl2 → 6C + D
Chất rắn khô Chất khí
Trong trường hợp dư khí Clo xảy ra phản ứng:
2A+3Cl2→ D (chất khí)+6E
Chất rắn C màu trắng, khi đốt nó bị phân hủy thuận nghịch biến thành chất A và chất E. Khối lượng riêng của chất khí D là 1,25 g/l (đktc). Hãy xác định các chất A, B, C, D, E và viết phương trình hóa học của các phản ứng.
Bài giải: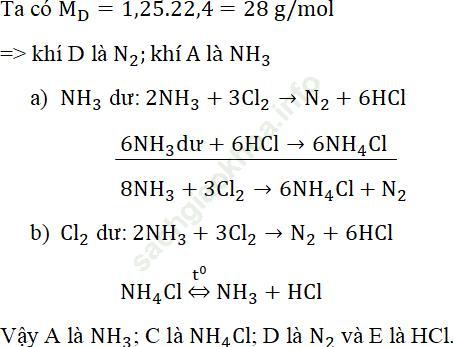
Bài 3 (trang 58 sgk Hóa 11 nâng cao): Hãy chọn đáp án đúng trong các trường hợp sau:
a) Phản ứng giữa kim loại magie với axir nitric đặc giả thiết chỉ tạo ra đnitơ oxit. Tổng các hệ số trong phản ứng hóa học bằng.
A. 10
B. 18
C. 24
D. 20
b) Phản ứng giữa kim loại Cu với axit nitric đặc giả thiết chỉ tạo ra nito monoxit. Tổng các hệ số trong Phương trình hóa học bằng:
A. 10
B. 18
C. 24
D. 20
Bài giải:a) Đáp án đúng là: C.
Phương trình phản ứng:
4Mg + 10HNO3 đặc→ 4Mg (NO3)2 + N2 O + 5H2O
Thông thường trong chương trình phổ thông:
Mg + 4HNO3 đặc→ Mg (NO3)2 + 2N2 + 2H2O
b) Đáp án đúng là: D.
Phương trình phản ứng:
3Cu + 8HNO3 loãng→ 3Cu (NO3)2 + 2NO + 4H2O
Bài 4 (trang 58 sgk Hóa 11 nâng cao): Bằng phản ứng hóa học, hãy nhận biết các dung dịch sau:
NH3, (NH4)2SO4,NH4 Cl, Na2SO4. Viết các Phương trình hóa học.
Bài giải:Nhận biết các dung dịch NH3, (NH4)2SO4,NH4 Cl, Na2SO4
Dùng đũa thủy tinh nhúng vào dung dịch HCl đặc và đưa vào mẫu thử trên, mẫu thử có khói trắng xuất hiệu là dung dịch NH3.
NH3+HCl→ NH4 Cl
Dùng dung dịch Ba (OH)2 cho vào 3 mẫu thử còn lại.
Mẫu sủi bọt mùi khai, đồng thời tạo kết tủa trắng là dung dịch (NH4)2SO4.
(NH4)2SO4+Ba (OH)2 → BaSO4+2NH3+2H2O
Mẫu sủi bọt khí mùi khai là dung dịch NH4 Cl
2NH4 Cl+Ba (OH)2→ BaCl2+2NH3+2H2O
Mẫu tạo kết tủa trắng là dung dịch Na2SO4
Na2SO4+Ba (OH)2→ BaSO4+2NaOH
Bài 5 (trang 58 sgk Hóa 11 nâng cao): Trong quá trình tổng hợp ammoniac, áp suất trong bình phản ứng giảm đi 10,0% so với áp suất lúc ban đầu. biết nhịệt độ của phản ứng được giữa không đổi trước và sau phản ứng. hãy xác định thành phần phần trăm thể tích của hỗn hợp khí thu được sau phản ứng, nếu trong hỗn hợp ban đầu lượng nitơ và hiđro được lấy đúng theo hệ số tỉ lượng.
Bài giải:Xét hỗn hợp ban đầu 1 mol N2 và 3 mol H2. Đặt số mol N2 tham gia phản ứng là x mol.

Áp suất của hệ lúc đầu là: P1 = 10P, theo đề bài áp suất giảm 10% ⇒ áp xuất của hệ sau là P2 = 9P
Trước phản ứng ta có: P1V1 = n1RT1 (1)
Sau phản ứng: P2V2 = N2RT2 (2)
Bình kín và nhiệt độ không đổi, lấy (1) chia (2) ta được:
Hỗn hợp khí thu được sau phản ứng: NH3 0,4 mol, N2 dư 0,8 mol; H2 dư 2,4 mol.
Tính phẩn trăm thể tích của mỗi khí trong hỗn hợp sau phản ứng: