Bài 11: Amoniac và muối amoni - Giải BT Hóa học 11 nâng cao
Bài 11: Amoniac và muối amoni
Bài 1 (trang 47 sgk Hóa 11 nâng cao): Mô tả và giải thích hiện tượng xảy ra trong thí nghiệm chứng minh ammoniac tan nhiều trong nước.
Bài giải:- Mô tả thí nghiệm: Lắp thí nghiệm như hình vẽ
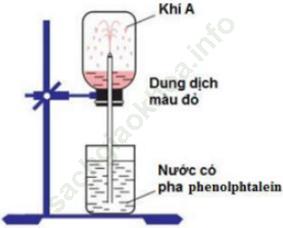
- Giải thích hiện tượng:
+ Amoniac tan nhiều trong nước tạo thành dd amoniac có tính bazo.
+ Do tan nhiều trong nước, áp suất của khí NH3 trong bình giảm đột ngột, nước trong cốc (có pha phenolphtalein) bị hút vào bình qua ống thủy tinh vuốt nhọn phun thành các tia màu hồng.
Bài 2 (trang 47 sgk Hóa 11 nâng cao): Có 5 bình đựng riêng biệt 5 chất khi: N2,O2, NH3, Cl2 và CO2. Hãy đưa ra một thí nghiệm đơn giản để nhận ra bình đựng khi NH3.
Bài giải:Cách 1. Dùng đũa thủy tinh nhúng vào lọ đựng dung dịch HCl và đưa vào lần lượt các bình mất nhãn trên nếu có khói trắng xuất hiện là bính đứng khi NH3:NH3 + HCl→ NH4Cl (rắn) khói trắng.
Cách 2. Dùng giấy quỳ tím tẩm nước tiếp xúc với miệng các bình khí. ở bình nào quỳ tím hóa xanh là NH3.
Bài 3 (trang 47 sgk Hóa 11 nâng cao): Nêu tính chất hóa học đặc trưng và những ứng dụng của amoniac. Tại sao người ta nói amoniac là một bazơ yếu?
Bài giải:- Tính chất hóa học của NH3
+ Tính bazơ yếu: NH3 + H2O ⇔ NH4+ + OH-
NH3+HCl → NH4 Cl (bốc khói trắng)
AlCl3 + 3NH3+H2O → Al (OH)3↓ + 3NH4 Cl
Cu (NO3)2 + 2NH3+H2O → Cu (OH)2↓ +2NH4 Cl
Khả năng tạo phức:
Cu (OH)2 + 4NH3 → [Cu (NH3)4] (OH)2
dung dịch xanh thẫm
Tính khử: 2NH3+3CuO → (to) 3Cu+N2+3H2O (2N3--6e → N2)
2NH3+3Cl2 → N2+6HCl (2N3--6e → N2)
Ứng dụng của amoniac
NH3 được sử dụng để làm sản xuất HNO3 phân bón, điều chế N2H4 làm nhiên liệu cho tên lửa.
NH3 lỏng được dùng làm chất gây lạnh trong máy lạnh.
NH3 là một bazơ yếu.
Với cùng nồng độ thì nồng độ OH- do NH3 tạo thành nhỏ hơn nhiều so với NaOH. NH3 bị bazơ đẩy ra khỏi dung dịch muối → NH3 là một bazơ yếu.
NH4 NO3+NaOH → NaNO3+NH3 ↑ + H2O
Bài 4 (trang 47 sgk Hóa 11 nâng cao): Dung dịch ammoniac có thể hòa tan được Zn (OH)2 là do
A. Zn (OH)2 là hiđroxit lưỡng tính.
B. Zn (OH)2 là một bazơ ít tan.
C. Zn (OH)2 có khả năng tạo thành phức chất tan tương tự như Cu (OH)2
D. NH3 là một hợp chất có cực là một bazơ yếu.
Bài giải:Đáp án đúng là: C. Zn (OH)2+4NH3 → [Zn (NH3)4] (OH)2
Bài 5 (trang 47 sgk Hóa 11 nâng cao): Viết Phương trình hóa học của các phản ứng thực hiện sơ đồ chuyển hóa sau:
Bài giải:
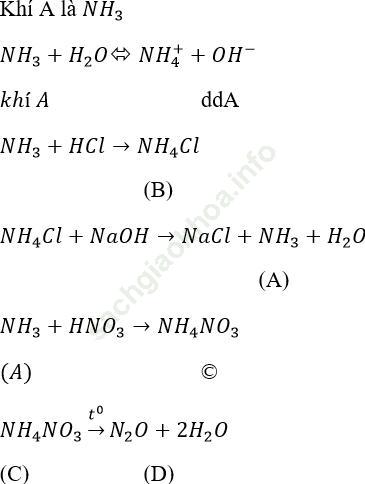
Bài 6 (trang 47 sgk Hóa 11 nâng cao): Cho cân bằng hóa học N2(k)+3H2 (k) ⇔ 2NH3 (k):Δ H=-92J Cân bằng trên sẽ chuyển dịch theo chiều nào (có giải thích) khi:
a) Tăng nhiệt độ
b) Hóa lỏng ammoniac để tách ra khỏi hỗn hợp phản ứng.
c) Giảm thể tích của hệ Phương trình.
Bài giải:Theo nguyên lí dịch chuyển cân bằng Lechateliter
Khi tăng nhịêt độ cân bằng hóa học dịch chuyển theo chiều thu nhịêt. Tức chiều nghịch, chiều phân hủy NH3
Khi hóa lỏng NH3 nồng độ NH3 giảm cân bằng hóa học sẽ dich chuyể theo chiều tăng làm nồng độ NH3 (chiều thuận) tạo thành NH3.
Giảm thể tích của hỗn hợp phản ứng cân bằng hóa học dịch chuyển theo chiều giảm áp xuất (chiều thuận) tạo ra NH3.
Bài 7 (trang 48 sgk Hóa 11 nâng cao):
Có thể phân biệt muối ammoniac với các muối khác bằng cách cho nó tác dụng với dung dịch kiềm, vì khi đó:
A. Thoát ra một chất khi màu xanh lục nhạt.
B. Thoát ra một chất khí không màu, mùi khai, làm xanh quỳ tím ẩm.
C. Thoát ra một chất khí màu nâu đỏ, làm quỳ tím xanh ẩm.
D. Thoát ra chất khí không màu không mùi.
Hãy chọn đáp án đúng.
Bài giải:Bài 8 (trang 48 sgk Hóa 11 nâng cao): Người ta có ta có thể sản xuất amoniac để điều chế urê bằng cách chuyển hóa hữu cơ xúc tác một hỗn hợp gồm không khí, hơi nước và khí metan (thành phần chính của khí thiên nhiên).
Phản ứng điều chế H2 và CO2: CH4+2H2O → CO2+4H2 (1)
Phản ứng thu N2 (từ không khí) và CO2: CH4+2O3→ CO2+2H2O (2)
Phản ứng tổng hợp NH3: N2+3H2 ⇔ 2NH3 (3)
Để sản xuất khí aminiac, nếu lấy 841,7m3 không khí (chứa 21,03% O2, 78,02% N2, còn lại là khí hiếm), thì cần phải lấy bao nhiêu m3 khí metan và bao nhiêu m3 hơi nước để đủ năng lượng N2 và H2 theo tỉ lệ 1: 3 về thể tích dùng cho phản ứng tổng hợp ammoniac. Giả thiết các phản ứng (1) và (2) đều xảy ra hoàn toàn và thể tích khí thu được đo ở điều kiện tiêu chuẩn
Bài giải:Thể tích khí O2 và N2 trong 841,7 m3 không khí:
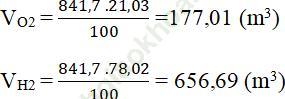
Từ pt (3) ta có: VH2 = 3. VN2 = 3.656,69 = 1970,08 m3
Từ pt (1) ta có: VCH4 = 1/4. VH2 = 1979,08/4 = 492,52 m3
VH2O = 1/2. VH2 = 1979,08/2 = 985,04 m3
Từ pt (2): VCH4 = 1/2. VO2 = 177,01/2 = 88,5 m3
VH2O tạo thành = VO2 = 177,01 m3
⇒ Tổng VCH4 cần dùng là: 492,52 + 88,5 = 581,02 m3
⇒ Tổng VH2O cần dùng là: 985,04 – 177,01 = 808,039 m3