Bài 10: Nitơ - Giải BT Hóa học 11 nâng cao
Bài 10: Nitơ
Bài 1 (trang 40 sgk Hóa 11 nâng cao): Ion nitrua N3- có cấu hình electron giống cấu hình electron nguyên tử của khí trơ nào, của ion halogenua và của ion kim loại kiềm nào? Hãy viết cấu hình của chúng.
Bài giải:- Cấu hình e của N: (Z = 7): 1s22s22p3
- Cấu hình e của N3-: (N + 3e → N3-): 1s22s22p6
- Cấu hình e của Ne (Z = 10): 1s22s22p6
- Cấu hình e của F- (F + e → F-): 1s22s22p6
- Cấu hình e của Na+ (Na → Na+ + e): 1s22s22p6
Bài 2 (trang 40 sgk Hóa 11 nâng cao): Trình bày cấu tạo của phân tử N2. Vì sao ở điều kiện thường N2 là một chất trơ? Ở điều kiện nào N2 trở nên hoạt động hơn?
Bài giải:- Công thức cấu tạo: N≡ N.
- Phân tử N2 có chứa liên kết ba nên năng lượng liên kết lớn ⇒ N2 rất bền ở nhiệt độ thường.
- Ở nhiệt độ cao nitơ trở nên hoạt đông hơn. Có khả năng phản rứng với H2, O2, kim loại.
Bài 3 (trang 40 sgk Hóa 11 nâng cao): Nêu những tính chất hóa học đặc trưng của nito và dẫn ra những phản ứng hóa học để minh họa
Bài giải:Tính chất hóa học của N2: N2 thể hiện tính khử và tính oxi hóa
Nito thể hiện tính khử
Nito thể hiện tính oxi hóa
Bài 4 (trang 40 sgk Hóa 11 nâng cao): Nêu những tính chất hóa học đặc trưng của nitơ và dẫn ra những phản ứng hóa học để minh họa.
Bài giải:Tính chất hóa học của đặc trưng của N2:N2 thể hiện tính khử và tính oxi hóa.
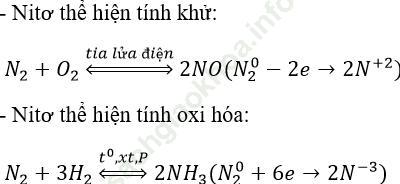
Bài 5 (trang 40 sgk Hóa 11 nâng cao): Bằng thí nghiệm nào có thể biết được nitơ có lẫn một tạp chất: Clo, Hidro clorua, hidosunfat? Viết Phương trình hóa học của các phản ứng xảy ra.
Bài giải:- Dẫn hỗn hợp khí trên qua dung dịch (KI + hồ tinh bột) thấy có màu xanh xuất hiện là có khí clo Cl2 + 2KI→ 2KCl + I2,I2 làm hồ tinh bột hóa xanh.
- Dẫn qua dung dịch Cu (NO3) có ↓ đen là H2 S.
H2S+Cu (NO3)2 → CuS↓ đen + 2HNO3
- Dẫn qua dung dịch AgNO3 có ↓ trắng là HCl.
HCl + AgNO3 → AgCl↓ trắng + HNO3
Bài 6 (trang 40 sgk Hóa 11 nâng cao): Trộn 200ml dung dịch natri nitrit 3M với 200ml dung dịch amoni clorua 2M rồi đun nóng cho đến khi phản ứng thực hiện xong. Xác định thể tích khí của khí nitơ sinh ra (đo ở đktc) và nồng độ mol của mỗi chất trong dung dịch sau phản ứng. Giả thiết thể tích dung dịch biến đổi không đáng kể.
Bài giải:nNH4Cl = 2.0,2 = 0,4 mol, nNaNO2 = 0,2.3 = 0,6 mol
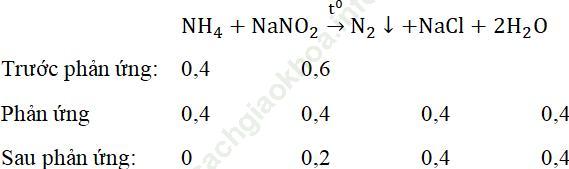
nN2 = nNH4Cl = 0,4 mol
Thể tích N2 sinh ra ở đktc: VN2 = 0,4.22,4 = 8,96 (lít)
Dung dịch sau phản ứng có thể tích = 0,2 + 0,2 = 0,4 (lít)
nNaCl = nNH4Cl = 0,4 mol
nNaNO2 dư = 0,6 – 0,4 = 0,2 mol
Nồng độ mol/lít của các muối: CMNaCl = 0,4/0,4 = 1M; CMNaNO2= 0,2/0,4 = 0,5M
Bài trước: Bài 9: Khái quát về nhóm nitơ - Giải BT Hóa học 11 nâng cao Bài tiếp: Bài 11: Amoniac và muối amoni - Giải BT Hóa học 11 nâng cao