Bài 15: Axit photphoric và muối photphat - Giải BT Hóa học 11 nâng cao
Bài 15: Axit photphoric và muối photphat
Bài 1 (trang 66 sgk Hóa 11 nâng cao): Viết công thức cấu tạo của axit điphotphoric, axit metanphotphoric và cho biêt axit này số oxi hóa của photpho là bao nhiêu.
Bài giải: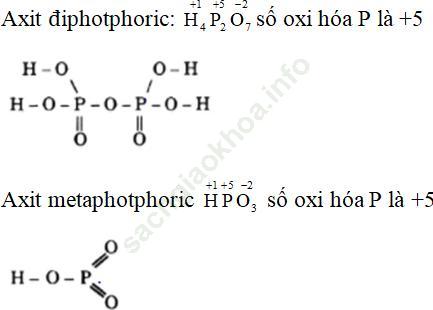
Bài 2 (trang 66 sgk Hóa 11 nâng cao): Viết Phương trình hóa học thực hiện dãy chuyển hóa sau đây:

Bài giải:
Chuỗi Phương trình
b) 4P+5O2 → 2P2O5
c) P2O5 +3H2O → 2H3PO4
d) H3PO4 +3NH3 → (NH4)3PO4
e) 2 (NH4)3PO4 +3H2SO4 → 3 (NH3)2SO4 +2H3PO4
f) 3Ca (OH)3 +2H3PO4 → Ca3(PO4)2 +6H2O
Bài 3 (trang 66 sgk Hóa 11 nâng cao): Điền chất thích hợp vào chỗ có dấu? trong các sơ đồ sau:
a) H2PO4-+? → HPO42-+?
b) HPO42-+? → H2PO4-+?
Bài giải:a) H2PO4-+OH- → HPO42-+H2O
b) HPO42- + H3O+ → H2PO4-+H2O
Bài 4 (trang 66 sgk Hóa 11 nâng cao): Bằng Phương pháp hóa học, hãy phân biệt dung dịch HNO3 và dung dịch H3PO4
Bài giải:Cách 1. Trung hòa hai axit bằng dung dịch NaOH, sau đó dùng dung dịch AgNO3 nhận biết ion PO43- vì tạo kết tủa màu vàng.
3Ag++PO43- → Ag3PO4↓
Cách 2. Cho bột Cu tác dụng với từng axit H3PO4 không tác dụng với Cu, chỉ có HNO3 tác dụng với Cu sinh ra khí không màu hóa nâu ngoài không khí hoặc khí màu nâu.
3Cu + 8HNO3loãng→ 3Cu (NO3)2 +2NO↑ +4H2O
Cu + 4HNO3đặc→ Cu (NO3)2+2NO2↑ +2H2O
Bài 5 (trang 66 sgk Hóa 11 nâng cao): Axit A là chất rắn, trong suốt, không màu, dễ tan trong nước. Khi thêm canxi oixt vào dung dịch A thì tạo thành hợp chất B màu trắng, không tan trong nước. Khi nung B ở nhiệt độ cao với cát và than thì tạo thành chất photpho có trong thành phần của A. Cho biết A, B là những chất gì? Viết phương trình hóa học của các phản ứng.
Bài giải:A là H3PO4,B là Ca3(PO4)2
2H3PO4+3CaO→ Ca3(PO4)2 + 3H2O
Bài 6 (trang 66 sgk Hóa 11 nâng cao): Thêm 0,15 mol KOH vào dung dịch chứa 0,1 mol H3PO4. Sau phản ứng, trong dung dịch muối có các muối.
A. K2PO4 và K2HPO4
B. KH2PO4 và K3PO4
C. K2HPO4 và K3PO4
D. KH2PO4,K2HPO4 và K3PO4
Bài giải:Đáp án đúng là: A.
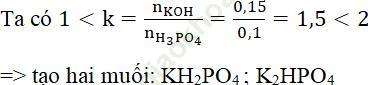
Bài 7 (trang 66 sgk Hóa 11 nâng cao): Thêm 6 gam P2O5 vào 25ml dung dịch H3PO4 6% (D=1,03 g/ml). Tính nồng độ phần trăm của H3PO4 trong dung dịch thu được.
Bài giải: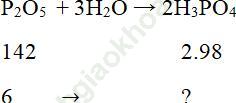
Khối lượng H3PO4 nguyên chất tạo từ 6 gam P2O5 là: 6.2.98/142=8,28 (g)
Khối lượng dung dịch H3PO4 trong 25 ml dung dịch H3PO4 (6%, D=1,03g/mol) là: mdd = D. V = 25.1,03 = 25,75 g
Khối lượng H3PO4 nguyên chất:
mct=6.25,75/100=1,545 (g)
Nồng độ phần trăm của H3PO4 trong dung dịch thu được sau khi thêm P2O5 là:
Bài 8 (trang 66 sgk Hóa 11 nâng cao): Rót dung dich chứa 11,76 gam H3PO4 vào dung dịch chứa 16,8 gam KOH. Tính khối lượng của từng khối lượng muối thu được sau khi cho dung dịch bay hơi đến khô.
Bài giải: