Phương pháp Tính nồng độ các chất ở trạng thái cân bằng cực hay - Chuyên đề Hóa 10
Phương pháp giải
Xét phản ứng đồng thể đơn giản tổng quát:
aA + bB ↔ cC + dD
- Khi hệ đạt trạng thái cân bằng: vthuận = vnghịch
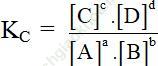
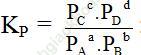
(Nồng độ các chất và áp suất các chất tại thời điểm cân bằng)
- Trong bình kín thì mt = ms
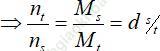
- Bình kín, nhiệt độ không đổi thì
Ví dụ minh họa
Ví dụ 1: Cho phương trình phản ứng: 2A (k) + B (k) ↔ 2X (k) + 2Y (k) Người ta trộn 4 chất, mỗi chất 1 mol vào bình kín dung tích 2 lít (không đổi). Khi cân bằng, lượng chất X là 1,6 mol. Nồng độ B ở trạng thái cân bằng lần lượt là:
A. 0,7M
B. 0,8M.
C. 0,35M.
D. 0,5M.
Bài giải:
Ban đầu có sẵn 1 mol X nên số mol X được tạo ra là 1,6 - 1 = 0,6 mol
2A(k) + B(k) ↔ 2X(k) + 2Y(k)
BĐ (n0): 1 1 1 1 (mol)
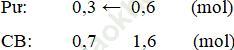
⇒ [B] = 0,7: 3 = 0,35M
⇒ Đáp án đúng là: C
Ví dụ 2: Trong bình kín dung tích 1 lít, người ta cho vào 5,6 gam khí CO và 5,4 gam hơi nước. Phản ứng xảy ra là: CO + H2O → CO2 + H2. Ở 850oC hằng số cân bằng của phản ứng trên là 1. Nồng độ mol của CO và H2O khi đạt đến cân bằng lần lượt là:
A. 0,2 M và 0,3 M.
B. 0,08 M và 0,2 M.
C. 0,12 M và 0,12 M.
D. 0,08 M và 0,18 M.
Bài giải:
Ban đầu: [CO] = 0,2M; [H2O] = 0,3M
Gọi [CO]pư = Am

Tại cân bằng: [CO] = 0,2 – a; [H2O] = 0,3 – a; [CO2] = a; [H2] = a
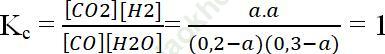
a = 0,12 ⇒ [CO] = 0,08M; [CO2] = 0,18M
⇒ Đáp án đúng là: D
Ví dụ 3: Một bình kín chứa NH3 ở 0oC và 1 atm với nồng độ 1 mol/l. Nung bình kín đó đến 546oC và NH3 bị phân huỷ theo phản ứng: 2NH3(k) → N2(k) + 3H2(k). Khi phản ứng đạt tới cân bằng áp suất khí trong bình là 3,3 atm, thể tích bình không đổi. Hằng số cân bằng của phản ứng phân huỷ NH3 ở 546oC là:
A. 1,08.10-4.
B. 2,08.10-4.
C. 2,04.10-3.
D. 1,04.10-4.
Bài giải:
Gọi nồng độ NH3 phản ứng là 2x

Vì thể tích dung dịch không đổi nên:
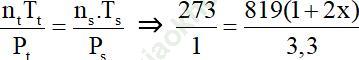
⇒ x = 0,05
Ta có:
⇒ Đáp án đúng là: C
Ví dụ 4: Cho cân bằng: N2O4 → 2NO2. Cho 18,4 gam N2O4 vào bình chân không dung tích 5,9 lít ở 27oC, khi đạt đến trạng thái cân bằng, áp suất là 1 atm. Hằng số cân bằng KC ở nhiệt độ này là:
A. 0,040. B. 0,007.
C. 0,00678. D. 0,008.
Bài giải:
nN2O4 = 0,2 mol
Gọi nN2O4 pư = x mol

ncân bằng = 0,2 – x + 2x = 0,2 + x = 0,24 ⇒ x = 0,04 mol
⇒ [NO2] = 0,04: 5,9 =; [N2O4] = 8/295
⇒ Đáp án đúng là: B
Ví dụ 5: Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là:
A. 10 atm. B. 8 atm.
C. 9 atm. D. 8,5 atm.
Bài giải:
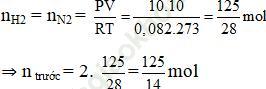

(hiệu suất tính theo H2)
Ta có thể tích và nhiệt độ không đổi
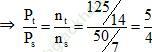
⇒ Psau = 10: 5/4 = 8 atm
⇒ Đáp án đúng là: B
Bài trước: 3 dạng bài tập Tốc độ phản ứng trong đề thi Đại học có lời giải - Chuyên đề Hóa 10