Dạng 4: Xác định nguyên tố thuộc 2 nhóm A liên tiếp trong Bảng HTTH - Chuyên đề Hóa 10
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Những kiến thức cần lưu ý:
- Nếu tổng số hiệu nguyên tử 4 < ZT < 32 thì A, B sẽ thuộc các chu kỳ nhỏ hay ZA - ZB = 8.
- Nếu ZT > 32 thì cần phải xét cả 3 trường hợp:
+ A là H.
+ A và B cách nhau 8 đơn vị.
+ A và B cách nhau 18 đơn vị.
Do 2 nguyên tố thuộc cùng một nhóm nên tính chất tương tự nhau, vì vậy với những bài toán liên quan đến hỗn hợp phản ứng ta thay hỗn hợp bằng một công thức chung, sau đó tìm rồi chọn hau nguyên tố thuộc hau chu kì của cùng nhóm sao cho:
MA < < MB (MA < MB)
Ví dụ minh họa
Ví dụ 1: A và B là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32. Hãy viết cấu hình electron của A, B và của các ion mà A và B có thể tạo thành.
Bài giải:
Theo bài ra, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32 nên ZA + ZB = 32.
Trường hợp 1: ZB - ZA = 8. Ta tìm được ZA = 12; ZB = 20.
Cấu hình electron:
A: 1s22s22p63s2 (chu kỳ 3, nhóm IIA).
và B: 1s22s22p63s23p64s2 (chu kỳ 4, nhóm IIA).
Ion A2+: 1s22s22p6 và B2+: 1s22s22p63s23p6.
Trường hợp 2: ZB - ZA = 18. Ta tìm được ZA = 7; D = 25.
Cấu hình electron:
A: 1s22s22p3 (chu kỳ 2, nhóm VA).
và B: 1s22s22p63s23p63d54s2 (chu kỳ 4, nhóm VIIB).
Trường hợp này A, B không cùng nhóm nên không thỏa mãn.
Ví dụ 2. Cho 8,8 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp nhau và thuộc nhóm IIIA, tác dụng với HCl dư thì thu được 6,72 lít khí hidro (đktc). Dựa vào bảng tuần hoàn cho biết tên hai kim loại đó.
Bài giải:
Kí hiệu 2 kim loại nhóm IIIA là M, nguyên tử khối trung bình là
Phương trình hóa học có dạng: 2M + HCl → 2MCl2 + 3H2
nH2 = 6,72/22,4 = 0,3 (mol)
nM = 2/3 nH2 = 0,2 (mol)
Theo bài ra ta có: . 0,2 = 8,8
=> = 44
Hai kim loại thuộc 2 chu kì liên tiếp, một kim loại có nguyên tử khối nhỏ hơn 44 và một kim loại có nguyên tử khối lơn hơn 44.
Dựa vào bảng tuần hoàn, hai kim loại đó là: Al (M = 27 < 44) và Ga (M = 69,72 > 44).
Ví dụ 3: Hòa tan 20,2 gam hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp thuộc nhóm IA trong bảng tuần hoàn tác dụng với nước thu được 6,72 lít khí (đktc) và dung dịch A. Xác định tên và khối lượng của 2 kim loại đã cho.
Bài giải:
Gọi R là kí hiệu chung của 2 kim loại nhóm IA, R cũng là nguyên tử khối trung bình của 2 kim loại. Ta có PTPƯ như sau:
2R + 2H2O → 2ROH + H2 ↑
0,6 0,3
nH2 = 6,72/22,4 = 0,3 (mol)
R = 20,2/0,6 = 33,67
Vì 2 kim loại thuộc 2 chu kì liên tiếp nên một kim loại phải có nguyên tử khối nhỏ hơn 33,67 và kim loại còn lại có nguyên tử khối lớn hơn 33,67.
=> R1 = 23 (Na) < R = 33,67 < R2 = 39 (K)
Dựa vào bảng tuần hoàn, ta xác định được hai kim loại đó là Na và K.
2Na + 2H2O → 2NaOH + H2 ↑
x x/2
2K + 2H2O → 2KOH + H2 ↑
y y/2
Ta có hệ phương trình:
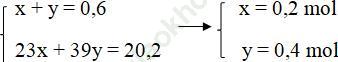
mNa = 23.0,2 = 4,6 (gam)
mK = 39.0,4 = 15,6 (gam)
B. Bài tập trắc nghiệm
Câu 1. Hòa tan 5,6 gam hỗn hợp hai kim loại X và Y thuộc nhóm IA vào 174,7 gam nước thu được 180 gam dung dịch A. Xác định tên kim loại X và Y. Biết chúng ở hai chu kì liên tiếp.
Đặt là khối lượng nguyên tử trung bình của hai kim loại.
2+ 2H2O → 2
OH + H2 (1)
0,3 0,3 0,15
Áp dụng định luật bảo toàn khối lượng:
mhh + mH2O = mddA + mH2 → mH2 = 5,6 + 174,7 - 180 = 0,3 (gam)
→ nH2 = (0,3)/2 = 0,15 (mol)
Theo (1): n= 0,3 mol →
= 5,6/0,3 = 18,67
Vì hai kim loại ở hai chu kì liên tiếp nên X là Li (MX = 7), Y là nA (MY = 23)
Câu 2. Biết rằng X, Y là hai nguyên tố thuộc cùng một phân nhóm chính ở hai chu kì liên tiếp trong bảng tuần hoàn các nguyên tố, có tổng số proton trong hai hạt nhân là 32. Hãy viết cấu hình e của nguyên tử X và Y.
Gọi ZX, ZY lần lượt là số proton của nguyền tố X và Y.
Theo đề bài, ta có: ZX + ZY = 32 (1)
Vì X, Y ở cùng phân nhóm chính và ở 2 chu kì kế tiếp nhau nên số proton của nhúng khác nhau hoặc là 8; 18,32 đơn vị. Xét 3 trường hợp sau. Giả sử ZY > ZX
Trường hợp 1: ZY - ZX = 8 (2)
Giải (1) và (2) ⇒ ZX = 12; ZY = 20
Cấu hình electron của (X): ls22s22p63s2
Cấu hình electron của (Y): ls22s22p63s23p64s2
Phù hợp với đề bài (2 chu kì liên tiếp và ở phân nhóm chính) nên nhận.
Trường hợp 2: ZY - ZX = 18 (3)
Giải (1) và (3) ⇒ ZX = 7; ZY = 25
Vậy: Cấu hình electron của.. (X): ls22s22p3 thuộc chu kì 2
Cấu hình electron của (Y): ls22s22p63s23p64s23d5: thuộc chu kì 4. Vậy laoij trường hợp này vì không thỏa mãn điều kiện đề bài.
Trường hợp 3: ZY - ZX = 32 (3)
Giải (1) và (4) ⇒ ZY= 32; ZX = 0 (loại)
Vậy nhận trường hợp 1.
Câu 3. Hỗn hợp A gồm 2 kim loại X, Y thuộc hai chu kì liên tiếp ở phân nhóm IIA. Cho 2,64 gam A tác dụng hết với dung dịch H2SO4 loãng thu được 2,016 khí (đktc). Xác định X, Y.
Thay thế hỗn hợp kim loại bằng một kim loại tương đương M−.
Số mol H2 = 0,09 (mol)
+ H2SO4 → M ̅SO4 + H2
(mol) 0,09 ← 0,09
⇒ = 2,64/0,09 = 29,33
⇒ Mg = 24 < 29,33 < 40 = Ca
X, Y là Mg, Ca.
Câu 4. Hòa tan hoàn toàn 6,645 gam hỗn hợp muối clorua của hai kim loại kiềm thuộc hai chu kì kế tiếp nhau vào nước được dung dịch X. Cho toàn bộ dung dịch X tác dụng hoàn toàn với dung dịch AgNO3 (dư), thu được 18,655 gam kết tủa. Tìm 2 kim loại kiềm.
Ta có: nNaCl = 18,655/143,5=0,13 mol
Cl + AgNO3 →
NO3 + AgCl
0,13 mol 0,13 mol
⇒ (+ 35,5). 0,13 = 6,645 →
= 15,62
Mà 2 kim loại kiềm thuộc hai chu kì kế tiếp nhau
→ Hai kim loại đó là Li (7) và Na (23)
Câu 5. A, B là 2 kim loại nằm ở hai chu kì liên tiếp thuộc nhóm IIA. Cho 4,4 gam một hỗn hợp gồm A và B tác dụng với HCl 1M (dư) thu được 3,36 lít khí (đktc).
a) Viết các phương trình phản ứng và cho biết tên hai kim loại trên.
b) Tính thể tích dung dịch HCl đã dùng, biết rằng HCl dùng dư 25% so với lượng cần thiết.
a) Gọi công thức chung của hai kim loại là M.
Ta có phương trình phản ứng như sau:
M + 2HCl → MCl2 + H2
nM = nH2 = 0,15
Ta có: MA = 4,4 → M = 4,4/0,15 = 29,33
A và B là 2 kim loại nằm ở 2 chu kì liên tiếp thuộc nhóm IIA nên A là Mg và B là Ca.
b) nHCl = 0,15.2= 0,3 mol ⇒ VHCl = 0,3/1 =0,3 lít = 300 ml.
VHCl đã dùng = 300 + 25%. 300 = 375 ml.
Câu 6. Cho 10,2 gam hỗn hợp hai kim loại thuộc nhóm IA và ở hai chu kì liên tiếp trong bảng tuần hoàn, tác dụng với H2O dư thu được 5,6 lít khí H2 (đktc). Xác định tên của hai kim loại đem dùng.
Gọi kim loại thuộc hai chu kì liên tiếp và thuộc nhóm IA là: X và Y (MX < MY).
Gọi kim loại chung của hai kim loại này là: A−
2A− + 2H2O → 2A−OH + H2 ↑ (1)
(mol) 0,5 ← 0,25
Ta có: nH2 = 5,6/22,4 = 0,25 (mol). Từ (1) ⇒ nA = 0,5 (mol)
MA = (10,2)/0,5 = 20,4 ⇒ MX < MA = 20,4 < MY
Vậy X là Li (M = 7) và Y là nA (M = 23)
Câu 7. Cho 6,6 gam một hỗn hợp hai kim loại thuộc nhóm IIA và thuộc hai chu kì liên tiếp nhau tác dụng với dung dịch HCl dư thu được 5,04 lít khí H2 (đktc). Hãy xác định hai kim loại trên.
Gọi kim loại thứ nhất là A và kim loại thứ hai là B, giả sử MA < MB.
Vì A, B đều thuộc nhóm IIA nên đều có hóa trị II
⇒ Gọi kim loại chung cho hai kim loại trên là (Với MA < M− < MB)
Ta có: nH2 = 5,04/22,4 = 0,225 (mol)
Phản ứng: + 2HCl →
Cl2 + H2 ↑ (1)
mol 0,225 ← 0,225
Từ (1) ⇒ nM− = × 0,225 = 6,6 ⇒
= 29,33
Dựa vào bảng tuần hoàn ⇒ Cặp nghiệm duy nhất là: A (Mg) và B (Ca).
Câu 8. X và Y là hai nguyền tố thuộc hai chu kì liên tiếp nhau và cùng thuộc một nhóm A, trong đó X có điện tích hạt nhân nhỏ hơn Y. Tổng số proton trong hạt nhân nguyên tử của X và Y là 22. Xác định hai nguyên tố X, Y.
Theo đề bài, ta có: ZX + ZY = 22 (1)
Nếu X, Y thuộc hai chu kì nhỏ thì (ZX < ZY): ZY = ZX + 8 (2)
Từ (1) và (2) ⇒ ZX = 7; ZY = 15.
Vậy X là N, Y là P.
Nếu X thuộc chu kì nhỏ và Y thuộc chu kì lớn thì: ZY = ZX + 18 (3)
Từ (1) và (3) ⇒ ZX = 2; ZY = 20 (loại vì không thảo mãn đề bài).
Nếu X, Y thuộc hai chu kì lớn: ZY = ZX + 32 (4)
Từ (1) và (4) ⇒ ZX < 0 (loại)