Dạng 1: Xác định nguyên tố dựa vào số hạt - Chuyên đề Hóa 10
A. Phương pháp & Ví dụ
Nguyên tử của mỗi nguyên tố có một số Z đặc trưng nên để xác định nguyên tố ta cần xác định Z thông qua việc lập và giải phương trình về số hạt.
a) Dạng toán cơ bản cho 1 nguyên tử
Phương pháp:
- Căn cứ vào Z sẽ xác định được nguyên tử đó là thuộc nguyên tố hóa học nào
- Chú ý: Z = số proton (p) = số electron (e) = E
Số khối: A = Z + N
Tổng số hạt = 2. Z + N
Tổng số hạt mang điện = Z + E = 2Z
Ví dụ 1: Tổng số hạt cơ bản của 1 nguyên tử X là 82, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 22. Tìm X?
Bài giải:
Ta có: 2. Z + N = 82 (1)
2. Z - N = 22 (2)
Từ (1) và (2) => Z = (82 + 22)/4 = 26
Vậy X là Fe
Công thức áp dụng nhanh: Z = (S + A)/4
Trong đó:
Z: Số hiệu nguyên tử
S: Tổng số hạt
A: Hiệu số hạt mang điện và không mang điện
b) Dạng toán áp dụng cho hỗn hợp các nguyên tử
Phương pháp:
Nếu là MxYy thì có thể coi có x nguyên tử M và y nguyên tử Y.
Do đó: x. ZX + y. ZY = (Sphân tử + Aphân tử) / 4
Ví dụ 2: Tổng số hạt cơ bản trong phân tử X có công thức là M2O là 140, trong phân tử X thì tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44. Tìm X?
Bài giải:
Trong X có 2 nguyên tử M và 1 nguyên tử O.
=> 2. ZM + 8 = (140 + 44): 4 = 46
⇒ Z = 19
Vậy M là K ⇒ X là K2O
Áp dụng mở rộng công thức trên trong giải ion
➢ Nếu ion là Xx+ thì ZX = (S + A + 2x) / 4
➢ Nếu ion Yy- thì ZY = (S + A – 2y) / 4
Vậy khác biệt của công thức này với công thức ban đầu đó là thêm giá trị của điện ion
Ghi nhớ: Nếu ion dương thì đem + 2 lần giá trị điện ion dương, nếu âm thì – 2 lần giá trị điện ion âm).
Ví dụ 3: Tổng số hạt cơ bản của ion M3+ là 79, trong đó tổng số hạt mang điện nhiều hơn không mang điện là 19. Tìm M?
Bài giải:
Ta có: ZM = (79 + 19 +2.3): 4 = 26
⇒ M là sắt Fe.
c) Dạng toán cho tổng số hạt cơ bản
Phương pháp:
Với dạng này thì ta phải kết hợp thêm bất đẳng thức:
1 ≤ N/Z ≤ 1,52 (với 82 nguyên tố đầu bảng tuần hoàn)
1 ≤ (S −2Z)/Z ≤ 1,52 ⇒ S/3,52 ≤ Z ≤ S/3
Thường với 1 số nguyên tố đầu độ chênh lệch giữa p và n không nhiều, thường là 1 hoặc 2, vì thế sau khi chia S cho 3 ta thường chon luôn giá trị nguyên gần nhất.
Ngoài ra có thể kết hợp công thức:
S = 2Z + N = Z + (Z + N) hay là S = Z + A
Ví dụ 4: Tổng số hạt cơ bản của nguyên tử X là 52, X thuộc nhóm VIIA. Tìm X?
Bài giải:
Ta có: Z ≤ 52: 3 = 17,33
⇒ Z là Clo (Cl)
ZM ≤ 60: 3 = 20
⇒ Ca, ZX ≤ 24: 3 = 8 ⇒ O
Vậy MX là CaO.
B. Bài tập trắc nghiệm
Câu 1. Cho nguyên tử X có tổng số hạt là 34, trong đó số hạt mang điện gấp 1,8333 lần số hạt không mang điện. Xác định số khối X?
A. 23 B. 24 C. 27 D. 11
Đáp án: A
Ta có, tổng số hạt trong nguyên tử: P + N + E = 34
Mà P = E = Z ⇒ 2Z + N = 34
Mặt khác số hạt mang điện gấp 1,8333 lần số hạt không mang điện nên:
2Z = 1,8333N
⇒ 1,8333N + N = 34
⇒ N = 12
⇒ Z = 11
Vậy X có Z = 11 nên điện tích hạt nhân là 11+
Số khối của X: A = Z + N = 23
Câu 2. Một nguyên tử nguyên tố A có tổng số proton, nơtron, electron là 52. Cho biết A là nguyên tố gì?
A. Mg B. Cl C. Al D. K
Đáp án: B
Ta có: 2Z + N = 52
Do bài toán có hai ẩn nhưng chỉ có một dữ kiện để lập phương trình nên ta sử dụng thêm giới hạn
1 ≤ N/Z ≤ 1,222 hay 52/3,222 ≤ Z ≤ 52/3
⇒ 16,1 ≤ Z ≤ 17,3.
Chọn Z = 17
⇒ N = 18
⇒ A = 35
Vậy nguyên tố A là Clo
Câu 3. Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Tìm số khối của nguyên tố X?
A. 27 B. 26 C. 28 D. 23
Đáp án: A
Ta có: p + n + e = 40 vì p = e
⇒ 2p + n = 40 (1)
Hạt mang điện: p + e = 2p
Hạt không mang điện: n.
Theo bài ra ta có: 2p – n = 12 (2)
Từ 1 và 2 ⇒ p = e = 13; n = 14
⇒ A = p + n = 27
Số khối của nguyên tố X là 27. Đáp án: A
Câu 4. Tổng số hạt proton, nơtron, electron trong hai nguyên tử kim loại X và Y là 142, trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 42. Số hạt mang điện của nguyên tử Y nhiều hơn của X là 12. Tìm hai kim loại X và Y.
A. Na, K. B. K, Ca. C. Mg, Fe. D. Ca, Fe.
Đáp án: D
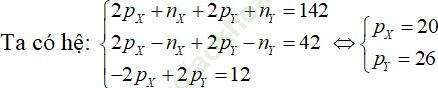
Câu 5. Tổng số hạt proton, nơtron và electron trong nguyên tử nguyên tố X là 155, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt. X là nguyên tố nào sau đây?
A. Al B. Fe C. Cu D. Ag
Đáp án: D
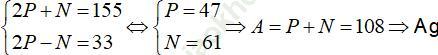
Câu 6. Một ion X3+ có tổng số hạt proton, nơtron, electron là 79, trong đó số hat mang điện nhiều hơn số hạt không mang điện là 19. Viết kí hiệu của nguyên tử X.
Đáp án: A
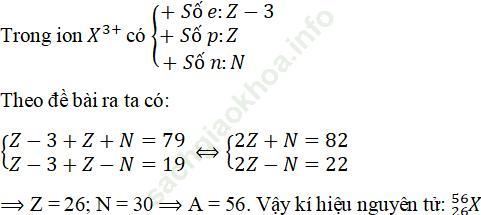
⇒ Z = 26; N = 30 ⇒ A = 56. Vậy ki hiệu nguyên tử: 2656)X
Câu 7. Tổng số các hạt trong nguyên tử M là 18. Nguyên tử M có tổng số hạt mang điện gấp đôi số hạt không mang điện. Tìm kí hiệu nguyên tử của M?
Đáp án: A
Tổng số hạt trong nguyên tử: P + N + E = 18
Mà P = E = Z ⇒ 2Z + N = 18
Măt khác tổng số hạt mang điện gấp đôi số hạt không mang điện
2Z = 2N ⇒ Z = N = 6 ⇒ A = 12
Kí hiệu nguyên tử M: 612C.
Câu 8. Mỗi phân tử XY2 có tổng các hạt proton, nơtron, electron bằng 178; trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn số hạt mang điện của Y là 12. Tìm kí hiệu hoá học của X, Y?
A. Fe và S B. S và O C. C và O D. Pb và Cl
Đáp án: A
Kí hiệu số đơn vị điện tích hạt nhân của X là ZX, Y là ZY; số nơtron (hạt không mang điện) của X là NX, Y là NY. Với XY2, ta có các phương trình:
Tổng số hạt của X và Y là: 2 ZX + 4 ZY + NX + 2 NY = 178 (1)
Số hạt mang điện nhiều hơn không mang điện là: 2. ZX + 4. ZY - NX – 2. NY = 54 (2)
Số hạt mang điện của X ít hơn số hạt mang điện của Y là: 4. ZY – 2. ZX = 12 (3)
Từ (1), (2) và (3) => ZY = 16; ZX = 26
Vậy X là sắt, Y là lưu huỳnh ⇒ XY2 là FeS2