Dạng 4: Các dạng bài tập về Oxi – Ozon
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Để giải các dạng bài tập về Oxi – Ozon, học sinh cần dựa vào phản ứng ozon hóa:
3O2 → 2O3: Phản ứng làm giảm số mol khí
2O3 → 3O2: Phản ứng làm tăng số mol khí
Sau đó, áp dụng phương pháp tăng – giảm thể tích để giải bài toán.
- Bài toán về điều chế oxi:
Trong phòng thí nghiệm, O2 được điều chế bằng cách nhiệt phân các chất giàu oxi và kém bền với nhiệt như KClO3, KMnO4,...
2KClO3 → 2KCl + 3O2
2KMnO4 → K2MnO4 + MnO2 + O2
Từ phản ứng ta thấy khối lượng giảm của chất rắn sau phản ứng chính là khối lượng O2 được giải phóng. Vì vậy, cần vận dụng phương pháp bảo toàn khối lượng để giải dạng này theo phương pháp tăng, giảm khối lượng.
mO2 = mchất rắn ban đầu - mchất rắn sau phản ứng
Ví dụ minh họa
Ví dụ 1: Hỗn hợp khí B gồm O2 và O3 có tỉ khối hơi so với H2 là 19,2. Tính % về thể tích mỗi khí trong B.
Bài giải:
Ta có: DB/H2 = 19,2
=> MB = 19,2.2 = 38,4
Áp dụng quy tắc đường chéo, ta có:
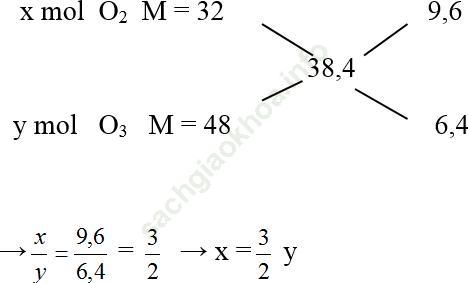
Giả sử: nO3 = y = 2 mol thì nO2 = x = 3 mol => nB = 2 + 3 = 5 mol
% về thể tích = % về số mol
=> %O2 = ![]() = 60%
= 60%
% O3 = 100 – 60 = 40%
Ví dụ 2: Có hỗn hợp khí oxi và ozon. Sau một thời gian, ozon bị phân hủy hết, ta được một chất khí duy nhất có thể tích tăng thêm 2%. Hãy xác định thành phần phần trăm theo thể tích của hỗn hợp khí ban đầu. Biết các thể tích khí đo được ở cùng điều kiện nhiệt độ và áp suất.
Bài giải:
Học sinh có thể giải bài toán theo 2 cách như sau:
Cách 1: Đặt x và y lần lượt là số mol O2 và O3 trong hỗn hợp:
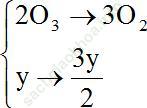
Số mol hỗn hợp khí trước khi phản ứng là: (x+ y) (mol)
Số mol phản ứng, số mol khí oxi là: 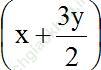 (mol)
(mol)
Số mol khí tăng so với ban đầu là: 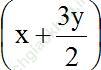 - (x + y) = 0,5y
- (x + y) = 0,5y
Ta có 0,5y ứng với 2% nên y ứng với 4%.
Suy ra O3 chiếm 4% và O2 chiếm 96%.
Cách 2. Áp dụng phương pháp tăng – giảm thể tích
Theo phản ứng ta có: 2O3 → 3O2
Nhận thấy: Cứ 2 mol O3 phản ứng, làm hỗn hợp tăng 1 mol khí. Vậy khi hỗn hợp tăng 2% thì %VO3là 4% => %VO2 chiếm 96%.
Ví dụ 3: Hỗn hợp khí X gồm O2 và O3 có tỉ khối hơi so với oxi là 1,3.
a) Tính % về khối lượng của mỗi khí trong hỗn hợp.
b) Cho 20,8 gam hỗn hợp X có thể đốt cháy hoàn toàn bao nhiêu gam benzen (C6H6)
Bài giải:
a) Gọi a, b lần lượt là số mol O2 và O3
Theo bài ra ta có:
Thành phần % khối lượng mỗi khí:
%O2 =
b) Phương trình phản ứng đốt cháy:
2C6H6+ 15O2 ![]() 12CO2+ 6H2O (1)
12CO2+ 6H2O (1)
(mol) x → 15x/2
C6H6 + 5O3 ![]() 6CO2 + 3H2O (2)
6CO2 + 3H2O (2)
(mol) y → 5y
Ta có: ![]() × 32 + 5y × 48 = 30,8
× 32 + 5y × 48 = 30,8
Hay 240x + 240y = 20,8
⇒ x + y = 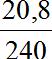
Từ (1) và (2) ⇒ 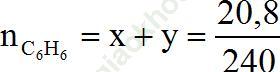
⇒ 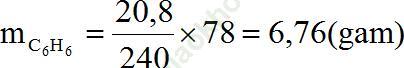
Ví dụ 4: Dẫn 2,688 lít hỗn hợp oxi và ozon (đktc) vào dung dịch KI dư thì thu được 20,32 gam iot kết tủa màu tím đen. Xác định thành phần phần trăm theo thể tích của mỗi khí trong hỗn hợp ban đầu?
Bài giải:
Ta có: nI2 = 0,08 (mol) và nhỗn hợp = 0,12 (mol)
O3 + 2KI + H2O → 2KOH + I2 + O2 ↑ (2)
(mol) 0,08 ← 0,08
Từ (1) ⇒ nO3 = 0.08 (mol)
⇒ nO2= 0,12 - 0,08 = 0,04 (mol)
Vì là chất khí nên %V = %n
Vậy: %VO3 = %nO3 = (0,08/0,12).100% = 66,67%
%VO2 = %nO2 = 100% - 66,67% = 33,33%
B. Bài tập trắc nghiệm
Câu 1. Dẫn 2,688 lít hỗn hợp oxi và ozon (đktc) vào dung dịch KI dư thì thu được 20,32 gam iot kết tủa màu tím đen. Cho biết thành phần phần trăm theo thể tích của mỗi khí trong hỗn hợp ban đầu là bao nhiêu?
A. 66,67% và 33,33%
B. 56,4% và 43,6%
C. 72% và 28%
D. 52% và 48%
Đáp án: A
Ta có: nI2 = 0,08 (mol) và nhỗn hợp = 0,12 (mol)
O3 + 2KI + H2O → 2KOH + I2 + O2 ↑ (2)
(mol) 0,08 ← 0,08
Từ (1) ⇒ nO3 = 0,08 (mol) ⇒ nO2 = 0,12 - 0,08 = 0,04 (mol)
Vì là chất khí nên %V = %n
Vậy:
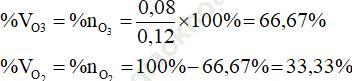
Câu 2. Hai bình có thể tích bằng nhau, nạp oxi vào bình thứ nhất, nạp oxi đã được ozon hóa vào bình thứ hai, thấy khối lượng 2 bình khác nhau 0,42g (nhiệt độ và áp suất ở 2 bình như nhau). Tính khối lượng oxi đã được ozon hóa?
A. 1,16g B. 1,26g C. 1,36g D. 2,26g
Đáp án: B
Khối lượng khác nhau ở 2 bình là do khối lượng oxi trong ozon:
→ nO3= nO (trong O3)= 0,42/16 = 0,02625 mol
Ta có: nO2(bị ozon hóa) = 3/2 nO3= 3/2.0,02625 = 0,039375 mol
→ mO2(bị ozon hóa) = 0,039375.32 = 1,26g
Câu 3. Khi đun nóng 11,07g KMnO4 ta được 10,11g bã rắn A và khí B. Xác định thể tích khí B (ở đktc) được giải phóng?
A. 6,72l B. 3,36l C. 0,672l D. 0,448l
Đáp án: C
Phương trình phản ứng:
2KMnO4 → K2MnO4 + MnO2 + O2 (1)
Từ (1) ta thấy khối lượng hỗn hợp rắn trước và sau phản ứng thay đổi là do O2 thoát ra ở dạng khí (O2 là B).
Áp dụng định luật bảo toàn khối lượng ta có:
mO2 = 11,07 – 10,11 = 0,96g → nO2 = 0,96/32 = 0,03 mol
→ VO2 = 0,03 × 22,4 = 0,672l
Câu 4. Khi tầng Ozon bị thủng thì:
A. Cây xanh không quang hợp được
B. Nhiệt độ của trái đất tăng lên
C. Tia tử ngoại sẽ xâm nhập vào trái đất, gây nên các căn bệnh ung thư
D. Không khí trên trái đất bị thoát ra ngoài vũ trụ.
Đáp án: C
Câu 5. Để phân biệt được oxi và ozon người ta làm thí nghiệm nào sau đây?
A. Dẫn lần lượt 2 khí qua nước
B. Dẫn lần lượt 2 khí qua dung dịch KI có tấm hố tinh bột
C. Dẫn lần lượt 2 khí qua dung dịch thuốc tím
D. Dẫn lần lượt 2 khí qua dung dịch nước vôi trong.
Đáp án: B
Câu 6. Khi đun nóng 126,4 gam kali pemanganat, thu được 6,72 lít khí oxi (đktc). Tính độ phân hủy của kali pemanganat và thành phần của chất rắn còn lại.
Ta có: nO2 = 6,72/22,4 = 0,3
2KMnO4 --to→ K2MnO4 + MnO2+ O2↑ (1)
(mol) 0,6 0,3 0,3 ← 0,3
Từ (1) ⇒ mK2MnO4phản ứng = 0,6(mol)
⇒ mK2MnO4phản ứng = 0,6 ×158=94,8 (gam)
⇒ Độ phân hủy của KMnO4 là: (94,8/126,4). 100 = 75%
Như vậy chất rắn thu được sau phản ứng gồm: KMnO4 dư, K2MnO4 và MnO2, có khối lượng là:
mK2MnO4dư = 126,4 – 94,8 =31,6 (gam)
mK2MnO4 =0,3.197 = 59,1(gam); mMnO2 = 0,3.87 = 26,1(gam)
Câu 7. Hỗn hợp khí X gồm O2 và O3 có tỉ khối hơi so với oxi là 1,3.
a, Xác định % về khối lượng của mỗi khí trong hỗn hợp.
b, Cho 20,8 gam hỗn hợp X có thể đốt cháy hoàn toàn bao nhiêu gam benzen (C6H6)
Gọi số mol O2 và O3 lần lượt là a, b
Theo đề bài:
dddX/O2 = 1,3 ⇒ MhhX = 1,3.32 = 41,6
Sử dụng phương pháp đường chéo:

Câu 8. Tiến hành phân hủy hết a gam ozon thì thu được 94,08 lít khí O2 (đktc). Tìm giá trị của a?
A. 134,4g B. 124g C. 67,2g D. 181,6g
Đáp án: A
Ta có: nO2 = 4,2(mol)
Phản ứng: 2O3 → 3O2 (1)
(mol) 2,8 ← 4,2
Từ (1) ⇒ nO3 = 2,8(mol) ⇒ 2,8.48 = 134,4(gam)