Dạng 3: Hoàn thành phương trình hóa học về Halogen - Chuyên đề Hóa 10
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Học sinh cần cắm vững các tính chất hóa học của các halogen và hợp chất của chúng
- Một số tính chất đặc trưng cần chú ý:
+ Halogen là những phi kim điển hình. Đi từ flo đến iot, tính oxi hoá giảm dần. Các halogen đứng trước đẩy halogen đứng sau nó ra khỏi dung dịch muối halogen.
+ Flo có độ âm điện lớn nhất vì thế trong tất cả các hợp chất chỉ có số oxi hoá 1. Các nguyên tố halogen khác, ngoài số oxi hoá –1 còn có các số oxi hoá +1, +3, +5, +7.
+ Tính khử của HX tăng dần từ HF < HCl < HBr < HI.
+ Tính axit của dung dịch HX tăng dần từ HF < HCl < HBr < HI.
+ Tính axit của HXO4: Giảm dần từ HClO4 > HBrO4 > HIO4.
Ví dụ minh họa
Ví dụ 1. Hoàn thành chuỗi phản ứng sau:
a) MnO2 → Cl2 → HCl → Cl2 → CaCl2 → Ca (OH) 2 → Clorua vôi
b) KMnO4 → Cl2 → KCl → Cl2 → axit hipoclorơ → NaClO → NaCl → Cl2 → FeCl3
Bài giải:
a) MnO2 → Cl2 → HCl → Cl2 → CaCl2 → Ca (OH) 2 → Clorua vôi
+) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2 O
+) H2 + Cl2 → 2HCl
+) 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2 O
+) Ca + Cl2 → CaCl2
+) CaCl2 + NaOH → Ca (OH)2 + NaCl
+) Cl2 + Ca (OH) 2 → CaOCl2 + H2O
b) KMnO4 → Cl2 → KCl → Cl2 → axit hipoclorơ → NaClO → NaCl → Cl2 → FeCl3
+) 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2 O
+) Cl2 + 2K → 2 KCl
+) 2KCl → 2K + Cl2
+) Cl + H2 O → HCl+ HClO
+) Cl2 + 2NaOH → NaCl + NaClO + H2 O
+) NaClO + 2HCl → Cl2 + NaCl + H2 O
+) 2NaCl + 2H2 O → H2 + 2NaOH + Cl2
+) 2Fe + 3Cl2 → 2FeCl3
Ví dụ 2. Cân bằng các phản ứng oxi hóa – khử sau:
a) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
b) KClO3 + HCl → KCl + Cl2 + H2O
c) KOH + Cl2 → KCl + KClO3 + H2O
d) Cl2 + SO2 + H2O → HCl + H2SO4
e) Fe3O4 + HCl → FeCl2 + FeCl3 + H2O
f) CrO3 + HCl → CrCl3 + Cl2 + H2O
g) Cl2 + Ca (OH) 2 → CaCl2 + Ca (OCl)2 + H2O
Bài giải:
a) 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2 O
b, KClO3 + 6HCl → KCl + 3Cl2 + 3H2 O
c, 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2 O
d, Cl2 + SO2 + 2H2O → 2HCl + H2 SO4
e, Fe3 O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
f, 2CrO3 + 12HCl → 2CrCl3 + 3Cl2 + 6H2 O
g, 2Cl2 + 2Ca (OH) 2 → CaCl2 + Ca (OCl)2 + 2H2O
Ví dụ 3: Hoàn thành các phương trình hóa học theo sơ đồ sau, ghi rõ điều kiện phản ứng (nếu có):
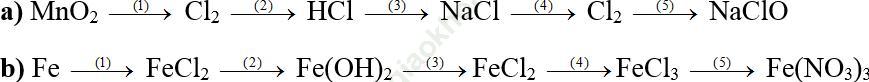
Bài giải:
a,
(1) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
(2) Cl2 + SO2 + 2H2 O → 2HCl + H2SO4
(3) 2Na + 2HCl → 2NaCl + H2
(4) 2NaCl + 2H2 O ![]() H2 ↑ + 2NaOH + Cl2
H2 ↑ + 2NaOH + Cl2
(5) Cl2 + 2NaOH → NaCl + NaClO + H2 O
b,
(1) Fe + HCl → FeCl2 + H2
(2) FeCl2 + NaOH → Fe (OH) 2 + NaCl
(3) Fe (OH) 2 + 2HCl → FeCl2 + 2H2O
(4) 2FeCl2 + Cl2 → 2FeCl3
(5) FeCl3 + 3AgNO3 → Fe (NO3)3 + 3AgCl
B. Bài tập trắc nghiệm
Câu 1. Viết phương trình hóa học của phản ứng thực hiện các biến hóa dưới đây, ghi tên các chất và điều kiện của phản ứng.
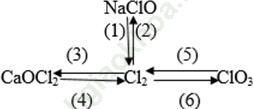
Đáp án:
(1) Cl2 + 2NaOH → NaCl + NaClO + H2O
(2) NaClO + 2HCl → NaCl + Cl2 + H2O
(3) Cl2 + Ca (OH)2 rắn → CaOCl2 + H2O
(4) CaOCl2 + 2HCl → CaCl2 + Cl2 + H2O
(5) 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
(6) KClO3 +6HCl → 3Cl2 + KCl + 3 H2O
Câu 2. Hoà tan khí Clo vào dung dịch KOH đặc, nóng, dư. Dung dịch thu được có các chất thuộc dãy nào sau đây?
A. KCl, KClO3, Cl2.
B. KCl, KClO3, KOH, H2O.
C. KCl, KClO, KOH, H2O.
D. KCl, KClO3.
Đáp án: B
3Cl2+ 6 KOH → 5KCl + KClO3 + 3H2O
Câu 3. Hoà tan khí clo vào dung dịch KOH loãng, nguội, dư. Dung dịch thu được có các chất thuộc dãy nào sau đây?
A. KCl, KClO3, Cl2.
B. KCl, KClO3, KOH, H2O.
C. KCl, KClO, KOH, H2O.
D. KCl, KClO3.
Đáp án: C
Cl2+ 2 KOH → KCl + KClO + 3H2O
Câu 4. Cho các chất: KOH (1), Zn (2), Ag (3), Al (OH)3 (4), KMnO4 (5), K2SO4 (6). Axit HCl tác dụng được với những chất nào?
A. (1), (2), (4), (5).
B. (3), (4), (5), (6).
C. (1), (2), (3), (4).
D. (1), (2), (3), (5).
Đáp án: A
HCl + KOH → KCl + H2O
Zn + 2HCl → ZnCl2 + H2
Al (OH)3 + 3HCl → AlCl3 + 3H2O
2KMnO4 + 16HCl → 5Cl2 + 2KCl + 2MnCl2 +8 H2O
Câu 5. Cho các chất: CuO (1), Zn (2), Ag (3), Al (OH)3 (4), KMnO4 (5), PbS (6), MgCO3 (7), AgNO3 (8), MnO2 (9), FeS (10). Axit HCl không tác dụng được với những chất nào?
A. (1), (2).
B. (3), (4).
C. (5), (6).
D. (3), (6).
Đáp án: D
Do Ag đứng sau H2 trong dãy hoạt động hóa học nên không tác dụng được với axit HCl và H2SO4 loãng
PbS là muối không tan trong axit nên không phản ứng
FeS cũng là muối không tan nhưng tan được trong axit.
* Một số lưu ý về muối sunfua
- Tan trong nước: Na2S, K2S, (NH4)2S, BaS, …
- Không tan trong nước nhưng tan trong HCl, H2SO4 loãng: FeS, ZnS, MnS, …
- Không tan trong nước và không tan trong HCl, H2SO4 loãng: CuS, PbS, Ag2S, SnS, CdS, HgS…
- Không tồn tại trong nước: MgS, Al2S3, …
Câu 6. Cho các phản ứng:
(1) O3 + dung dịch KI →
(2) F2 + H2O -to→
(3) MnO2 + HCl đặc -to→
(4) Cl2 + dung dịch H2S →
Những phản ứng tạo ra đơn chất là?
A. (1), (2), (3).
B. (1), (3), (4).
C. (2), (3), (4).
D. (1), (2), (4).
Đáp án: A
(1) O3 + 2KI + H2O → I2 + O2 + 2KOH
(2) 2F2 + 2H2O -to→ O2 + 4HF
(3) MnO2 + 4HCl đặc -to→ Cl2 + MnCl2 + 2H2O
(4) 4Cl2 + H2S + 4H2O → H2SO4 + 8HCl
Câu 7. Cho sơ đồ chuyển hóa:
Fe3O4 + dung dịch HI (dư) X + Y + H2O
Biết X, Y là sản phẩm cuối cùng của quá trình chuyển hóa. Tìm X và Y?
A. Fe và I2.
B. FeI3 và FeI2.
C. FeI2 và I2.
D. FeI3 và I2.
Đáp án: C
Fe3O4 + 8 HI 3FeI2 + I2 + 4H2O
Câu 8. Cho sơ đồ:
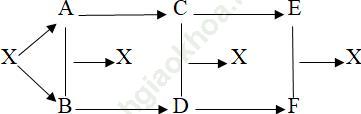
Viết các phản ứng xảy ra theo sơ đồ trên với X là NaCl.
2NaCl -đp→ 2Na + Cl2
2Na + Cl2 → 2NaCl
2Na + 2H2O → 2NaOH + H2
Cl2 + H2 → 2HCl
NaOH + HCl → NaCl + H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
2HCl + Ba (OH)2 → BaCl2 + 2H2O
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl