Dạng 6: Muối halogen tác dụng với AgNO3 - Chuyên đề Hóa 10
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Học sinh cần ghi nhớ chỉ có các muối Cl-, Br-, I- mới tạo kết tủa với dung dịch AgNO3. AgF tan nên muối F- không có phản ứng này.
- Áp dụng phương pháp tăng giảm khối lượng để giải nhanh các dạng bài tập này.
Ví dụ minh họa
Ví dụ 1. Cho 3,87 gam hỗn hợp muối natri của hai halogen liên tiếp tác dụng với dung dịch AgNO3 dư thu được 6,63g kết tủa. Xác định hai halogen kế tiếp đó.
Bài giải:
Phương trình phản ứng như sau:
NaX + AgNO3 → AgX + NaNO3
Có: mNaX = 3,87, mAgX = 6,63
Áp dụng phương pháp tăng giảm khối lượng
⇒ nNaX = (6,63 - 3,87)/ (108 - 23) = 0,324 mol
MNaX = 3,87/0,324 = 119,18
⇒ MX = 96,1
Vậy hai halogen liên tiếp thỏa mãn là: Br2 và I2
Ví dụ 2. Chất A là muối canxi halogenua. Cho dung dịch chứa 0,2 gam A tác dụng với lượng dư dung dịch AgNO3 thì thu được 0,376 gam kết tủa bạc halogenua. Tìm công thức của A.
Bài giải:
Ta có phương trình hóa học như sau:
CaX2 + 2AgNO3 → Ca (NO3)2 + 2AgX (X là halogen)
Áp dụng phương pháp tăng giảm khối lượng
Theo phương trình cứ 1 mol CaX2 tham gia phản ứng tạo 2 mol AgX.
Khối lượng AgX tăng so với khối lượng CaX2 là:
(2.108 + 2MX) – (40 – 2MX) = 176
Theo bài ra, số mol CaX2 tham gia phản ứng là:
(0,376 - 0,2)/176 = 10 - 3 (mol)
=> MCaX2 = 0,2/10-3 = 200
=> 40 + 2MX = 200
=> MX = 80
Vậy X là Brom (Br).
Công thức của A là: CaBr2
Ví dụ 3. Thêm 78ml dung dịch AgNO3 10% (khối lượng riêng 1,09 g/ml) vào một dung dịch có chứa 3,88g hỗn hợp kali bromua (KBr) và natri iotua (NaI). Lọc bỏ kết tủa. Nước lọc phản ứng vừa đủ với 13,3 ml dung dịch axit clohiđric nồng độ 1,5 mol/1. Hãy xác định thành phần phần trăm khối lượng từng chất trong hỗn hợp muối ban đầu và tính thể tích hiđro clorua ở điều kiện tiêu chuẩn cần dùng để tạo ra lượng axit clohiđric đã dùng.
Bài giải:
Ta có:
nAgNO3= (78.1,09.10)/ (100.170) = 0,05 mol;
nHCl = 0,01333.1,5 = 0,0199 ≈ 0,02 mol
Phương trình hóa học:
AgNO3 + KBr → AgBr + KNO3 (1)
AgNO3 + NaI → AgI + NaNO3 (2)
AgNO3 + HCl → AgCl + HNO3 (3)
Gọi số mol KBr, NaI trong hỗn hợp lần lượt là x và y.
Theo bài ra ta có: 119x + 150y = 3,88 (*)
Từ (1), (2) và (3) => x + y + 0,02 = 0,05 (**)
Từ phương trình (*) và (**) => x = 0,02; y = 0,01
%mKBr = (0,02.119)/3,88.100% = 61,34%;
%mNaI = 100% - 61,34% = 38,66%
Vậy thể tích hiđro clorua ở điều kiện tiêu chuẩn cần dùng là:
VHCl = 0,02 × 22,4 = 0,448 lít.
B. Bài tập trắc nghiệm
Câu 1. Cho 31,84 gam hỗn hợp NaX, NaY (X, Y là hai halogen ở 2 chu kỳ liên tiếp) vào dung dịch AgNO3 dư, thu được 57,34 gam kết tủa.
a) Tìm công thức của NaX, NaY.
b) Tính khối lượng mỗi muối thu được.
a) Phương trình phản ứng của NaX và NaY với AgNO3.
NaX + AgNO3 → AgX↓ + NaNO3
a a
NaY + AgNO3 → AgY↓ + NaNO3
b b
- Lập hệ phương trình (gọi số mol NaX: a mol; số mol NaY: b mol)
→ X− = 83,13
Vì X < X− < Y ⇔ X < 83,13 < Y
→ X = 80 < 83,13 nên X là brom và Y = 127 > 83,13 nên Y là iot.
Công thức của 2 muối là: NaBr và NaI.
b)
⇒ mNaBr = 0,28 × 103 = 28,84 g
mNaI = 0,02 × 150 = 3g
Câu 2. Một hỗn hợp gồm 3 muối NaF, NaCl, NaBr nặng 4,82 gam hòa tan hoàn toàn trong nước được dung dịch A. Sục khí Cl2 dư vào dung dịch A rồi cô can hoàn toàn dung dịch sau phản ứng thu được 3,93 gam muối khan. Lấy một nửa lượng muối khan này hòa tan vào nước rồi cho phản ứng với dung dịch AgNO3 dư thì thu được 4,305 gam kết tủa. Viết các phương trình phản ứng xảy ra. Tính thành phần trăm khối lượng mỗi muối trong hỗn hợp ban đầu.
Khi sục khí Cl2 vào dung dịch chứa hỗn hợp ở muối NaF, NaCl, NaBr chỉ có NaBr tác dụng.
Đặt số mol hỗn hợp ban đầu: NaF: a mol; NaCl: b mol; NaBr: c mol
Viết các phương trình phản ứng và lập hệ phương trình:

Câu 3. Có hỗn hợp gồm 2 muối NaCl và NaBr. Khi cho dung dịch AgNO3 vừa đủ vào hỗn hợp trên người ta thu được khối lượng kết tủa bằng khối lượng AgNO3 tham gia phản ứng. Tìm % khối lượng mỗi muôi trong hỗn hợp ban đầu.
Ta có phương trình phản ứng như sau:
NaCl + AgNO3 → AgCl + NaNO3
a a a mol
NaBr + AgNO3 → AgBr + NaNO3
b b b mol
170a – 143,5a = 188b – 170b
26,5a = 18b
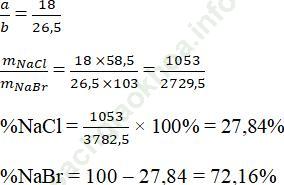
Câu 4. Cho 47,76 gam hỗn hợp gồm NaX, NaY (X, Y là hai halogen ở hai chu kì liên tiếp) vào dung dịch AgNO3 dư, thu được 86,01 gam kết tủa.
a) Tìm công thức của NaX, NaY.
b) Tính khối lượng mỗi muối
a) Gọi công thức của hai muối trên là: Na (MX < M− < MY).
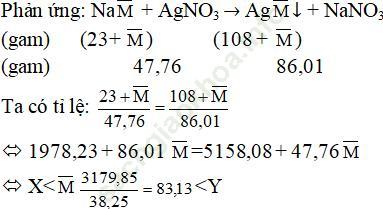
Vậy nghiệm hợp lý là: X: Brom (Br) và Y: Iot (I)
Công thức hai muối: NaBr và NaI
b) Theo đề bài, ta có hệ phương trình:
Giải hệ phương trình ta được: a = 0,42; b = 0,03
Vậy: mNaBr = 0,42 × 103= 43,26 (gam); mNaI = 0,03 × 150 = 4,5(gam)
Câu 5. Cho 300ml một dung dịch có hòa tan 5,85 gam NaCl tác dụng với 200ml dung dịch có hòa tan 34 gam AgNO3, người ta thu được một kết tủa và nước lọc.
a) Tính khối lượng chất kết tủa thu được.
b) Tính nồng dộ mol chất còn lại trong nước lọc. Cho rằng thể tích nước lọc thu được không thể thay đổi đáng kể.
Ta có: nNaCl = 5,85/58,8 = 0,1(mol) và nAgNO3 = 34/170 = 0,2(mol)
a) Tính khối lượng kết tủa:
NaCl + AgNO3 → AgCl↓ + NaNO3
(mol) 0,1 → 0,1→ 0,1→ 0,1
Từ (1) ⇒ nAgCl = 0,1(mol) ⇒ mAgCl↓ = 0,1 × 143,5 = 14,35 (gam)
b) Ta có: Vdung dịch = 300 + 200= 500 (ml) = 0,5 (lít)
Từ (1) ⇒ Dung dịch thu được chứa: NaNO3 = 0,1(mol) và AgNO3dư: 0,2-0,1 = 0,1(mol)
Vậy: CM (NaNO3) = CM (AgNO3)dư = 0,1/0,5 = 0,2
Câu 6. Cho 3,87 gam hỗn hợp muối natri của hai halogen liên tiếp tác dụng với dung dịch AgNO3 dư thu được 6,63g kết tủa. Tìm tên hai halogen.
Gọi x là số mol NaX
Trường hợp 1: Cả 2 halogen đều tạo kết tủa
NaX → AgX
3,87 6,63 g
Phương pháp tăng giảm khối lượng:
Δ m = 6,63 – 3,87 = 2,76g = x. (108 – 23)
⇒ x = 0.0325 mol
MNaX = 3,87/0,0325 = 119 ⇒ Xtb = 96 ⇒ 2 halogen: Br và I.
Trường hợp 2: chỉ có 1 halogen tạo kết tủa ⇒ 2 halogen là F và Cl
⇒ nAgCl = 0,042 mol ⇒ nNaCl = 0,042 mol
⇒ mNaCl = 0,042.58,5 = 2,458g
⇒ mNaF = 1,411g thỏa mãn
⇒ Có 2 cặp nghiệm thỏa mãn
Câu 7. Cho 78 ml dung dịch AgNO3 10% (d = 1,09) vào một dung dịch có chứa 3,88 gam hỗn hợp KBr và KI. Lọc kết tủa, nước lọc có thể phản ứng vừa đủ với 13,3 ml dung dịch HCl 1,5M. Vậy % khối lượng từng muối là:
A. KBr 72,8%, NaI 27,62% B. KBr 61,3%, NaI 38,7%
C. KBr 38,7%, NaI 61,3% D. KBr 59,3%, NaI 40,7%
Số mol các chất:
nAgNO3= (78 ×1,09 ×10)/ (100 ×170) = 0,05 mol
nHCl = 0,01995 mol
Gọi a, b là số mol của KBr và KI trong hỗn hợp.

Câu 8. Hòa tan một muối kim loại halogenua chưa biết hóa trị vào nước để được dung dịch X. Nếu lấy 250 ml dung dịch X (chứa 27 gam muối) cho vào AgNO3 dư thì thu được 57,4 gam kết tủa. Mặt khác, điện phân 125 ml dung dịch X trên thì có 6,4 gam kim loại bám ở catot. Xác định công thức muối.
Đặt ký hiệu kim loại là B, halogen là X.
Công thức của muối sẽ là BXn
BXn + AgNO3 → nAgX↓ + B (NO3)n
27 57,4 g
→ 13,5 28,7 g
BXn → B + nX
13,5 6,4 7,1 g
Trong 13,5g BXn có 7,1g X vậy trong đó 28,7 g AgX cũng chỉ có 7,1g X
→ mAg = 28,7 – 7,1 = 21,6g → nAg = 0,2 mol
Trong AgX tỉ lệ kết hợp theo số mol nAg: nX = 1: 1 → nX = 0,2 mol
MX = 7,1/0,2 = 35,5 ⇒ X là Clo
BCln + nAgNO3 → nAgCl↓ + B (NO3)n
0,2/n 0,2 mol
MBCln = 13,5/ (0,2/n) = 67,5n → MB + 35,5n = 67,5n; MB = 32n
Nếu n = 1 → MB = 32 (loại)
Nếu n = 2 → MB = 64 → B là Cu