Dạng 6: Xác định nguyên tố thông qua nguyên tử khối - Chuyên đề Hóa 10
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Muốn xác định tên nguyên tố, cần tìm được M dựa vào thành phần phần trăm nguyên tố M trong hỗn hợp; dựa vào các phản ứng hóa học, các tính chất của M. ….
Ví dụ minh họa
Ví dụ 1. Cho 10 gam kim loại A (thuộc nhóm IIA) tác dụng với H2O, thu được 6,11 lit khí H2 (đo ở 25oC và 1 atm).
a. Cho biết tên của kim loại M đã dùng.
b. Cho 4 gam kim loại A vào cốc đựng 2,5lit dung dịch HCl 0,06M thu được dung dịch B.
Bài giải:
Phương trình phản ứng như sau:
A + 2H2O → A (OH)2 + H2
a a
Số mol khí H2 = 0,25 (mol) ⇒ a = 0,25
Ta có: MA = 10/0,25 = 40 Vậy M là Ca.
b. Số mol Ca = 4/40 = 0,1 mol.
Các phương trình phản ứng xảy ra như sau:
Ca + 2HCl → CaCl2 + H2
(mol): 0,075 0,15 0,075
Ca + 2H2O → Ca (OH)2 + H2
(mol): 0,025 0,025
Dung dịch B gồm: CaCl2 = 0,075 mol và Ca (OH)2 = 0,025 mol.
Ví dụ 2. Oxit cao nhất của một nguyên tố ứng với công thức RO3. Hợp chất của nó với H2 có 5,88% H về khối lượng. Tìm nguyên tố R.
Bài giải:
Oxit cao nhất là RO3 → R thuộc nhóm VIA.
Hợp chất với hidro có dạng RH2.
Vậy nguyên tố R là lưu huỳnh (S).
Ví dụ 3: Nguyên tử của nguyên tố C có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của X với hidro, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxit cao nhất là:
A. 50,00%
B. 27,27%
C. 60,00%
D. 40,00%
Bài giải:
Cấu hình electron lớp ngoài cùng của X là: ns2np4
→ X thuộc nhóm IVA
→ Hợp chất khí với H là XH2
→ Oxit cao nhất là XO3.
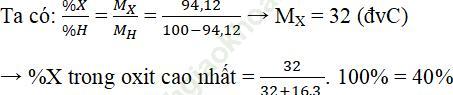
B. Bài tập trắc nghiệm
Câu 1: Oxit cao nhất của một nguyên tố ứng với công thức R2O5. Hợp chất của nó với hidro là một chất có thành phần không đổi với R chiếm 82,35% và H chiếm 17,65% về khối lượng. Xác định nguyên tố R.
Nguyên tố có oxit cao nhất là R2O5 → R thuộc nhóm VA.
→ Hợp chất với hidro: RH3
Câu 2: Oxit cao nhất của nguyên tố R có dạng R2O7. Sản phầm khí của R với hidro chứa 2,74% hidro về khối lượng. Tìm nguyên tử khối của R.
Oxit cao nhất của nguyên tố R có công thức R2O7.
→ Công thức hợp chất khí với hidro có dạng RH theo đề:
%H = 1/ (R+1). 100% = 2,74%
Giải ra ta có: R = 35,5 (clo). Cl
→ Công thức phân tử của oxit là Cl2O7
Công thức hợp chất khí với hidro là HCl.
Câu 3: Cho 3 gam hỗn hợp gồm kim loại Na và một kim loại kiềm X tác dụng hết với nước thu được dung dịch A. Để trung hòa dung dịch A phải dùng dung dịch chưa 200ml dung dịch HCl 1M.
a. Tìm kim loại kiềm X?
b. Tìm khối lượng mỗi kim loại trong hỗn hợp.
a) Thay hỗn hợp gồm Na và X bằng (
là nguyên tử khối trung bình của Na và X)
Ta có: 2 + 2H2O → 2
OH + H2
OH + HCl →
Cl + H2O
→ nM− = nMOH = nHCl = 0,2 mol
→ = 3/0,2 = 15 > MNa → MX < 15
Đó là Liti (M = 7)
b) Gọi a, b lần lượt là số mol của Na và Li có trong 3 gam hỗn hợp
Ta có: 23a + 7b = 3 và a + b = 0,2
→ a = b = 0,1 → mNa = 2,3 g; mLi = 0,7g
Câu 4: Nguyên tử Y có hóa trị cao nhất với oxi gấp 3 lần hóa trị trong hợp chất khí với hidro. Gọi X là công thức hợp chất oxit cao nhất, Z là công thức hợp chất khí với hidro của Y. Tỉ khối hơi của X đối với Z là 2,353. Tìm nguyên tố Y.
Gọi hóa trị cao nhất với H là nH và với oxi là nO.
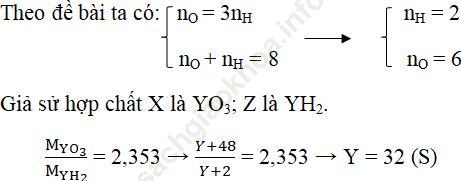
Câu 5: Muối X được tạo thành bởi một kim loại hóa trị 2 và phi kim hóa trị 1. Hòa tan 4,44 gam A vào H2O rồi chia làm hai phần bằng nhau:
- Cho phần 1 tác dụng với dung dịch AgNO3 dư thu được 5,74g kết tủa.
- Cho phần 2 tác dụng với dung dịch Na2CO3 dư thu được 2g kết tủa.
Xác định công thức muối X
Gọi A là nguyên tử khối (đvC) của kim loại A và B là nguyên tử khối (đvC) của phi kim B.
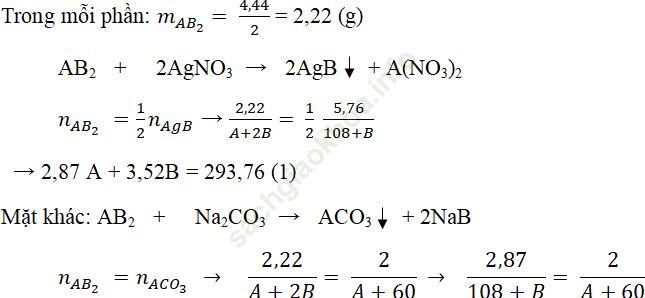
→ 2,87A – 2B = 43,8 (2)
Từ (1) và (2) → B = 35,5; A = 40
Vậy A là Ca, B là Cl. Công thức muối X: CaCl2.
Câu 6: M là kim loại thuộc nhóm IIA. Hòa tan hết 10,8 gam hỗn hợp kim loại muối cacbonat của nó trong dung dịch HCl, thu được 4,48 lít hỗn hợp khí A (đktc). Tỷ khối của A so với khí hidro là 11,5.
1. Tìm kim loại M
2. Tính % thể tích các khí trong A.
Gọi số mol các chất trong hỗn hợp đầu: M = a mol; MCO3 = b mol.
M + 2HCl → MCl2 + H2 (1)
(mol): a a
MCO3 + 2HCl → MCl2 + CO2 + H2O (2)
(mol): b b
Số mol A = 4,48/22,4 = 0,2 nên a + b = 0,2 (3)
MA = 11,5 x 2 = 23 nên (2a + 44b)/ (a + b) = 23 hay 2a + 44b = 4,6 (4)
Theo bài: Ma + (M + 60)b = 10,8 (5)
Từ (3), (4), (5) ta tìm được: a = 0,1 mol, b = 0,1 mol, M = 24 (Mg)
% VH2 = 50%; VCO2 = 50%
Câu 7: Có 5,56 gam hỗn hợp A gồm Fe và kim loại M (hóa trị n). Chia A làm 2 phần bằng nhau:
Phần 1: Hòa tan hết trong dung dịch HCl được 1,568 lit khí H2.
Phần 2: Hòa tan hết trong dung dịch H2SO4 đặc nóng thu được 2,016 lit khí SO2.
Viết các phương trình phản ứng xảy ra và tìm tên kim loại M. Biết rằng các khí đo ở đktc.
Phần 1:
Fe + 2HCl → FeCl2 + H2
(mol): x x
2M + 2nHCl → 2MCln + nH2
(mol): y 0,5ny
Số mol H2 = 0,07 nên x + 0,5ny = 0,07.
Phần 2:
2Fe + 6H2SO4(đặc) → Fe2(SO4)3 + 3SO2 + 6H2O
x 1,5x
2M + 2nH2SO4(đặc) → M2(SO4)n + nSO2 + 2nH2O
y 0,5nx
Số mol SO2 = 0,09 nên 1,5x + 0,5ny = 0,09 ⇒ x = 0,04 và ny = 0,06.
Mặt khác: 56x + My = 2,78
⇒ My = 0,54 ⇒ M = 9n.
Lần lượt xét n =1,2,3 ta được đáp án phù hợp là n = 3 ⇒ M = 27 (Al)
Câu 8: Hòa tan hết a gam oxit kim loại M (thuộc nhóm IIA) bằng một lượng vừa đủ dung dịch H2SO4 17,5% thu được dung dịch muối có nồng độ 20%. Tìm công thức oxit kim loại M.
Gọi số mol oxit MO = x mol.
MO + H2SO4 → MSO4 + H2O
(mol): x x x
Ta có: (M + 16)x = a

Từ đây ta tìm được M = 24 (magie). Oxit kim loại cần tìm là MgO.