Dạng 3: Hoàn thành phản ứng hóa học Oxi, Lưu huỳnh - Chuyên đề Hóa 10
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Học sinh cần nắm chắc các tính chất hóa học về oxi, ozon, lưu huỳnh và các hợp chất của chúng để thấy được mối quan hệ giữa các chất.
- Với những bài ẩn tên chất yêu cầu tìm chất phù hợp và viết phương trình cần lựa chọn các chất tương ứng với các trạng thái oxi hóa của lưu huỳnh trong sơ đồ. Quá trình làm tăng trạng thái oxi hóa các nguyên tố lưu huỳnh cần lựa chọn cho tác dụng với chất có tính oxi hóa. Ngược lại, quá trình làm giảm trạng thái oxi hóa của nguyên tố lưu huỳnh thì cần lựa chọn cho tác dụng với chất có tính khử.
Ví dụ minh họa
Ví dụ 1: Hãy viết các phương trình hóa học biểu diễn sự biến đổi số oxi hóa của các nguyên tố lưu huỳnh theo sơ đồ sau:
Bài giải:

Ví dụ 2: Viết các phương trình phản ứng theo chuỗi biến hóa sau:
a) KClO3 → O2 → O3 → O2 → ZnO → ZnSO4
b) FeS → H2S → S → SO2 → CaSO3 → CaSO4
Bài giải:
a) 2KClO3 ![]() 2KCl + 3O2
2KCl + 3O2
3O2 ![]() 2O3
2O3
O3 + 2Ag → Ag2O + O2
O2 + 2Zn → 2ZnO
ZnO + H2SO4 → ZnSO4 + H2O
b) FeS + 2HCl → FeCl2 + H2S↑
2H2S + O2 thiếu![]() 2S + 2H2O
2S + 2H2O
S + O2 ![]() SO2
SO2
SO2 + CaO → CaSO3
CaSO3 + H2SO4 → CaSO4 + H2SO4 + SO2
Ví dụ 3: Hoàn thành sơ đồ biến hóa sau:
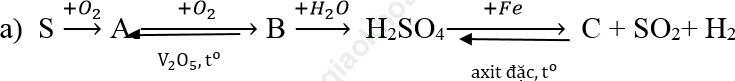

Bài giải:
S + O2 ![]() SO2
SO2
2SO2 + O2 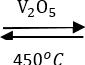 2SO3
2SO3
SO3 + H2O → H2SO4
6H2SO4 đặc + 2Fe ![]() Fe2 (SO4)3 + 3SO2 + 6H2O
Fe2 (SO4)3 + 3SO2 + 6H2O
S + H2 ![]() H2S↑ (A) (mùi trứng thối)
H2S↑ (A) (mùi trứng thối)
S + O2 ![]() SO2 (B)
SO2 (B)
S + Fe ![]() FeS (E)
FeS (E)
2H2S + SO2 → 3S + 2H2O
(X) ⇒ S, (D) ⇒ H2O
SO2 + Br2 + 2H2O → 2HBr + H2SO4
(Y) ⇒ HBr, (Z) ⇒ H2SO4
FeS + 2HBr → FeBr2 + H2S↑
(G) ⇒ FeBr2 (A) ⇒ H2S
Hoặc FeS + H2SO4 → FeSO4+ H2S↑
(G) ⇒ FeSO4 (A) ⇒ H2S
Ví dụ 4: Hoàn thành chuỗi các phản ứng sau, ghi rõ điều kiện nếu có:
ZnS → H2S → S → SO2 → SO3 → H2SO4 → HCl → Cl2 → KClO3 → O2
Bài giải:
ZnS + 2HCl → ZnCl2 + H2S
2H2S + O2 thiếu → 2S + 2H2O
S + O2 ![]() SO2
SO2
2SO2 + O2 ![]() 2SO3
2SO3
SO3+ H2O → H2SO4
H2SO4 đặc + NaCl tinh thể → NaHSO4 + HCl
4HCl + MnO2 → Cl2 + MnCl2 + 2H2O
3Cl2 + 6KHO ![]() 5KCl + KClO3 + 3H2O
5KCl + KClO3 + 3H2O
2KClO3 ![]() 2KCl + 3O2
2KCl + 3O2
Ví dụ 5. Viết các phương trình hóa học biểu diễn sự biến đổi số oxi hóa của nguyên tố lưu huỳnh theo sơ đồ sau:
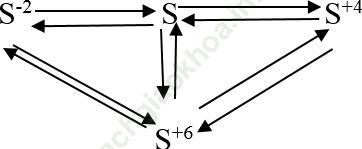
Bài giải:
+) S-2 → S0:
2H2S + O2 thiếu → 2S + 2H2O
+) S0 → S-2:
H2 + S ![]() H2S↑
H2S↑
+) S0 → S+4:
S + O2 ![]() S2
S2
+) S+4 → S0:
2H2S + SO2 → 3S + 2H2O
+) S+4 → S+6:
SO2+ Br2 + 2H2O → 2HBr + H2SO4
+) S+6 → S+4:
Cu + 2H2SO4 đặc ![]() CuSO4 + SO2 + H2O
CuSO4 + SO2 + H2O
+) S0 → S+6:
S + 3F2 → SF6
+) S+6 → S0:
3Zn + 4H2SO4 đặc ![]() 3ZnSO4 + S + 4H2O
3ZnSO4 + S + 4H2O
+) S-2 → S+6:
H2S+ 4Cl2 + 4H2O → H2SO4 + 8HCl
+) S+6 → S2-:
4Mg + 5H2SO4 đặc ![]() 4MgSO4 + H2S + 4H2O
4MgSO4 + H2S + 4H2O
Lưu ý: Với dạng bài tập này, học sinh cần lựa chọn các chất tương ứng cho phù hợp với các trạng thái oxi hóa của lưu huỳnh trong sơ đồ.
Quá trình làm tăng trạng thái oxi hóa các nguyên tố lưu huỳnh cầ lựa chọn cho tác dụng với chất có tính oxi hóa.
Ngược lại quá trình làm giảm trạng thái oxi hóa của nguyên tố lưu huỳnh cần lựa chọn cho tác dụng với chất có tính khử.
B. Bài tập trắc nghiệm
Câu 1. Hãy viết các phương trình phản ứng theo chuỗi biến hóa sau:
FeS → H2S → S → SO2 → CaSO3 → CaSO4
FeS + 2HCl → FeCl2 + H2S
2H2S + O2thiếu ---V2O5→ 2S + 2H2O
S + O2 ![]() SO2
SO2
SO2 + CaO → CaSO3
CaSO3 + H2SO4 → CaSO4 + SO2 + H2O
Câu 2. Xác định các chất và hoàn thành các phương trình phản ứng sau:
FeS + A → B (khí) + C
B + CuSO4 → D↓ đen + E
B + F → G↓ vàng + H
C + J khí → L
L + KI → C + M + N
FeS + 2HCl → FeCl2 + H2S↑
(A) (C) (B)
H2S + CuSO4 → CuS↓ + H2SO4
(D) (E)
2H2S + SO2 → 2S↓ + 2H2O
(F) (G) (H)
2FeCl2 + Cl2 → 2FeCl3
(J) (L)
2FeCl3 + 2KI → 2FeCl2 + 2KCl + I2
(M) (N)
Câu 3. Hoàn thành sơ đồ biến hóa sau:
S + O2 → SO2 (A)
SO3 + H2O → H2SO4
6H2SO4(đ) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
Câu 4. Viết phương trình phản ứng theo chuỗi biến hóa sau:
KMnO4 → Cl2 → NaClO3 → O2 → SO2 → SO3 → H2SO4
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
2NaClO3 → 2NaCl + 3O2
O2 + S → SO2
SO3 + H2O → H2SO4
Câu 5. Cặp phản ứng nào sau đây cho thấy lưu huỳnh vừa có tính khử vừa có tính oxi hóa?
A. S + H2 → H2S; S + Cu → CuS
B. S + 2H2SO4 → 3SO2 + 2H2O; S + 2Na → Na2S
C. S + 6HNO3 → H2SO4 + 6NO2 + 3H2O; S + O2 → SO2
D. S+ 3F2 → SF6; S + O2 → SO2
Đáp án: B
Câu 6. Lưu huỳnh tác dụng với natri hidroxit đặc, nóng theo phương trình phản ứng như sau:
S + NaOH → Na2S + Na2SO3 + H2O
Trong phản ứng trên, tỷ lệ số nguyên tử lưu huỳnh bị khử và số nguyên tử lưu huỳnh bị oxi hóa là?
A. 1: 2
B. 1: 1
C. 1: 2
D. 2: 1
Đáp án: D
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
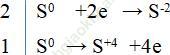
Câu 7. Cho phương trình phản ứng hóa học:
H2SO4 đặc + 8HI → 4I2 + H2S + 4H2O
Chọn phương án trả lời đúng!
A. H2SO4 là chất oxi hóa, HI là chất khử
B. HI là chất oxi hóa
C. I2 oxi hóa H2S thành H2SO4 và nó bị khử thành HI
D. I2 khử H2S thành H2SO4 và nó bị khử thành HI.
Đáp án: A
Câu 8. Cho các phương trình phản ứng hóa học sau:
1. SO2 + 2H2S → 3S + 2H2O
3. SO2 + Br2 + 2H2O → 2HBr + H2SO4
4.5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
5. SO2 + H2O → H2SO3
SO2 là chất oxi hóa trong các phản ứng:
A. 1,3,5 B. 1,3,4 C. 1 D. 1,3
Đáp án: C