Dạng 2: Xác định chất khử, chất oxi hóa trong phản ứng hóa học - Chuyên đề Hóa 10
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Trước hết cần xác định số oxi hóa.
Nếu trong phản ứng có chứa 1 hoặc nhiều nguyên tố có số oxi hóa thay đổi thì phản ứng đó thuộc loại oxi hóa – khử.
- Chất oxi hóa là chất nhận electron (ứng với số oxi hóa giảm)
- Chất khử là chất nhường electron (ứng với số oxi hóa tăng)
Ghi nhớ: khử cho – O nhận
- Tên của chất và tên quá trình ngược nhau
- Chất khử (cho e) - ứng với quá trình oxi hóa.
- Chất oxi hóa (nhận e) - ứng với quá trình khử.
Ví dụ minh họa
Ví dụ 1: Cho phản ứng: Ca + Cl2 → CaCl2.
Kết luận nào sau đây là đúng?
A. Mỗi nguyên tử Ca nhận 2e.
B. Mỗi nguyên tử Cl nhận 2e.
C. Mỗi phân tử Cl2 nhường 2e.
D. Mỗi nguyên tử Ca nhường 2e.
Bài giải:
Ta có:
Ca → Ca2++2e
Cl2 + 2.1e → 2Cl-
⇒ Đáp án đúng là: D
Ví dụ 2: Trong phản ứng: CaCO3 → CaO + CO2, nguyên tố cacbon
A. Chỉ bị oxi hóa.
B. Chỉ bị khử.
C. Vừa bị oxi hóa, vừa bị khử.
D. Không bị oxi hóa, cũng không bị khử.
Bài giải:
Ta có: C+4 → C+4
⇒ Đáp án đúng là: D
Ví dụ 3: Trong phản ứng: Cu + 2H2SO4 (đặc, nóng) → CuSO4 + SO2 + 2H2 O, axit sunfuric là... ?
A. là chất oxi hóa.
B. vừa là chất oxi hóa, vừa là chất tạo môi trường.
C. là chất khử.
D. vừa là chất khử, vừa là chất tạo môi trường.
Bài giải:
Ta có: S+6 → S+4 ⇒ Axit sunfuric đóng vai trò là chất oxi hóa
Mặt khác: SO42- đóng vai trò môi trường để tao muối CuSO4
⇒ Đáp án đúng là: B
Ví dụ 4. Trong phản ứng dưới đây, vai trò của H2S là gì?
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
A. chất oxi hóa.
B. chất khử.
C. Axit.
D. vừa axit vừa khử.
Bài giải:
Đáp án đúng là: B
Ví dụ 5. Cho các phản ứng sau, cho biết phản ứng nào là phản ứng oxi hóa – khử. Xác định chất khử, chất oxi hóa?
a) 2KMnO4 + 16HCl → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
b) BaO + H2O → Ba (OH)2
c) CuO + H2SO4 → CuSO4 + H2O
d) 2NaI + Cl2 → 2NaCl + I2
e) Br2 + 2KOH → KBr + KBrO + H2O
Bài giải:
Trong các phản ứng đã cho, phản ứng oxi hóa – khử là: a, d, e vì có sự thay đổi số oxi hóa giữa các nguyên tố.

B. Bài tập trắc nghiệm
Câu 1. Cho các chất và ion sau: Zn; Cl2; FeO; Fe2O3; SO2; H2S; Fe2+; Cu2+; Ag+. Số lượng chất và ion vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử là:
A. 2. B. 8. C. 6. D. 4.
Đáp án: D
Các chất vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử là: Cl2, FeO; SO2; Fe2+
Câu 2. Cho phản ứng: 4HNO3 đặc nóng + Cu → Cu (NO3)2 + 2NO2 + 2H2O.
Trong phản ứng trên, dung dịch HNO3 đóng vai trò là chất gì?
A. chất oxi hóa.
B. axit.
C. môi trường.
D. chất oxi hóa và môi trường.
Đáp án: D
Câu 3. Cho dãy các chất và ion sau: Cl2, F2, SO2, Na+, Ca2+, Fe2+, Al3+, Mn2+, S2-, Cl-. Số chất và ion trong dãy đều có tính khử và tính oxi hoá là?
A. 3. B. 4. C. 6. D. 5.
Đáp án: B
Các chất vừa có tính khử vừa có tính oxi hóa là: Cl2, SO2, Fe2+, Mn2+
Các chất chỉ có tính oxi hóa là: F2, Na+, Ca2+, Al3+
Các chất chỉ có tính khử là: S2-, Cl-
Câu 4. Trong phản ứng sau đây, H2SO4 đóng vai trò là... ?
Fe3O4 + H2SO4 đặc → Fe2(SO4)3 + SO2 + H2O
A. chất oxi hóa.
B. chất khử.
C. chất oxi hóa và môi trường.
D. chất khử và môi trường.
Đáp án: C
Câu 5. Trong phản ứng sau đây, chất bị oxi hóa là chất nào?
6KI + 2KMnO4 + 4H2O → 3I2 + 2MnO2 + 8KOH
A. KI.
B. I2.
C. H2O.
D. KMnO4.
Đáp án: A
Câu 6. Cho biết chất khử, chất oxi hóa và hoàn thành phương trình phản ứng sau:
MnO2 + HCl → MnCl2 + Cl2 + H2O
Đáp án:
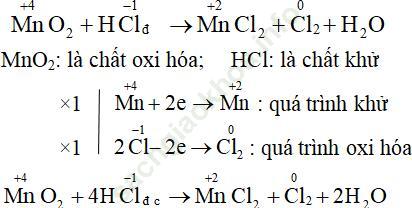
Câu 7. Trong phản ứng sau, HBr có vai trò là gì?
KClO3 + 6HBr → 3Br2 + KCl + 3H2O
A. vừa là chất oxi hóa, vừa là môi trường.
B. là chất khử.
C. vừa là chất khử, vừa là môi trường.
D. là chất oxi hóa.
Đáp án: B
Câu 8. Cho Cu tác dụng với dung dịch chứa H2SO4 loãng và NaNO3. Cho biết vai trò của NaNO3 trong phản ứng?
A. chất xúc tác.
B. môi trường.
C. chất oxi hoá.
D. chất khử.
Đáp án: C
Câu 9. Cho biết quá trình khử, quá trình oxi hóa và cân bằng phản ứng sau?
Cu + HNO3 → Cu (NO3)2 + NO2 + H2O
Đáp án:
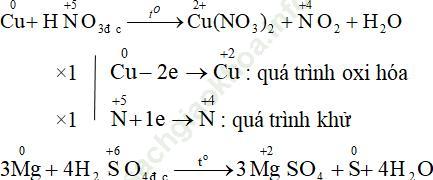
Câu 10. Trong phản ứng sau, vai trò của NO2 là gì?
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
A. chỉ bị oxi hoá.
B. chỉ bị khử.
C. không bị oxi hóa, không bị khử.
D. vừa bị oxi hóa, vừa bị khử.
Đáp án: D