Dạng 5: Halogen tác dụng với muối của halogen yếu hơn - Chuyên đề Hóa 10
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
*Chú ý: F2 không tác dụng được với muối của các halogen khác.
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
- Nên vận dụng phương pháp tăng giảm khối lượng để giải nhanh đối với dạng bài tập này.
Ví dụ minh họa
Ví dụ 1. Dẫn Cl2 vào 200 gam dung dịch KBr. Sau khi phản ứng cảy ra hoàn toàn khối lượng muối tạo thành nhỏ hơn khối lượng muối ban đầu là 4,45 gam. Tính nồng độ phần trăm KBr trong dung dịch ban đầu.
Bài giải:
Ta có phương trình phản ứng xảy ra như sau:
Cl2 + KBr → KCl + Br2
Áp dụng phương pháp tăng giảm khối lượng, ta có:
nMuối = 4,45 / (80 - 35,5) = 0,1 mol
⇒ mKBr = 0,1.119 = 11,9 g
C%KBr = 11,9/200 = 5,95%
Ví dụ 2. Cho Cl2 tác dụng với 30,9 gam NaBr sau một thời gian thu được 26,45 gam muối X. Tìm hiệu suất của phản ứng?
Bài giải:
Ta có phương trình phản ứng như sau:
Cl2 + NaBr → NaCl + Br2
nNaBr = 30,9/103 = 0,3 mol
nNaBr (phản ứng) = (30,9-26,45)/ (80-35,5)= 0,1 mol
=> Hiệu suất của phản ứng là: 0,1/0,3 = 33,33%
Ví dụ 3. Hỗn hợp rắn A gồm KBr và KI. Cho hỗn hợp A vào nước brom dư. Sau khi phản ứng xảy ra hoàn toàn, làm bay hơi dung dịch và nung nóng ta được sản phẩm rắn khan B. Khối lượng của B nhỏ hơn khối lượng A là m gam. Cho sản phẩm B vào nước clo dư. Sau khi phản ứng xong, làm bay hơi dung dịch và nung nóng ta được sản phẩm rắn khan C. Khối lượng của C nhỏ hơn khối lượng B là m gam. Tính % về khối lượng từng chất trong A?
A. KBr 3,87%, KI 96,13%
B. KBr 5,6%, KI 94,6%
C. KBr 3,22%, KI 96,88%
D. KBr 4,4%, KI 95,6%
Bài giải:
Gọi x, y lần lượt là số mol của KBr và KI
Khi dẫn A vào nước Brom, ta có:
2KI + Br2 → 2KBr + I2
y y mol
Sản phẩm B chứa (x + y) mol KBr
Ta có:
119x + 166y – 119 (x – y) = m
→ m = 47y (1)
Khi dẫn B vào nước clo
2KBr + Cl2 → 2KCl + Br2
x + y x + y
Theo bài ra ta có:
119 (x + y) – 74,5(x + y) = m
→ m = 44,5 (x + y) (2)
Từ (1) và (2) => 44,5(x + y) = 47y hay 44,5x = 2,5y → y = 17,8x
%KBr = 119x/ (119x + 166y) × 100% = 3,87%
%KI = 100% - 3,87% = 96,13%
B. Bài tập trắc nghiệm
Câu 1. Nước biển chứa một lượng nhỏ muối natri bromua. Bằng cách làm bay hơi nước biển, người ta thu được dung dịch chứa NaBr với hàm lượng 40g/l. Cần dùng bao nhiêu lít dung dịch đó và bao nhiêu lít khí clo (ở đktc) để điều chế 3 lít brom lỏng (khối lượng riêng 3,12 kg/l).
Ta có phương trình phản ứng như sau:
Cl2 + 2NaBr → 2NaCl + Br2
nBr2 = (3.3,12.103)/160 = 58,5 mol
→ nCl2 = 58,5 mol ứng với VCl2 = 58,5.22,4 = 1310,4l
nNaBr = 2nBr2 = 2.58,5 = 117 mol
Ứng với Vdd NaBr = (117.103)/40 = 301,275 ≈ 301,3l.
Vậy cần dùng 301.3 lít dung dịch NaBr và 1310.4 l Clo để điều chế 3 lít brom lỏng.
Câu 2. Có hỗn hợp muối NaCl và NaBr trong đó NaBr chiếm 20% khối lượng hỗn hợp. Hòa tan hỗn hợp vào nước, rồi cho khí clo lội qua dung dịch cho đến dư. Làm bay hơi dung dịch tới khi thu được muối khan. Hãy cho biết khối lượng hỗn hợp đầu đã thay đổi bao nhiêu phần trăm?
Ta có phương trình phản ứng xảy ra như sau:
Cl2 + 2NaBr → 2NaCl + Br2
Vì Cl2 dùng dư trên toàn bộ muối NaBr đã chuyển thành NaCl. Nghĩa là muối khan thu được chỉ chứa NaCl
Giả sử khối lượng của hỗn hợp ban đầu 100gam, trong đó khối lượng của NaBr là 20 gam và của NaCl là 80gam. Theo phản ứng ta có:
Cứ 103 gam NaBr tạo ra 58,5 gam NaCl
20 gam NaBr tạo ra x gam NaCl
x = (20.58,5)/103 = 11,36 (gam)
Khối lượng muối khan là: 80 + 11,36 = 91,36 (gam)
Khối lượng hỗn hợp ban đầu đã giảm: (100 - 91,36)/100 ×100 = 8,64%
Câu 3. Một hỗn hợp gồm 3 muối: NaF, NaCl và NaBr nặng 4,82 gam, đem hòa tan hoàn toàn chúng trong nước thu dược dung dịch A. Sục khí clo dư vào dung dịch A rồi cô cạn hoàn toàn dung dịch sau phản ứng thu được 3,93 gam muối khan. Lấy một nửa lượng muối khan này hòa tan vào nước rồi cho phản ứng với dung dịch AgNO3 dư thì thu được 4,305 gam kết tủa. Viết các phản ứng xảy ra và tính thành phần phần trăm theo khối lượng mỗi muối trong hỗn hợp ban đầu.
Gọi a, b, c lần lượt là số mol của NaF, NaCl, NaBr
Khi dẫn khí Cl2 vào dung dịch A thì chỉ có NaBr phản ứng:
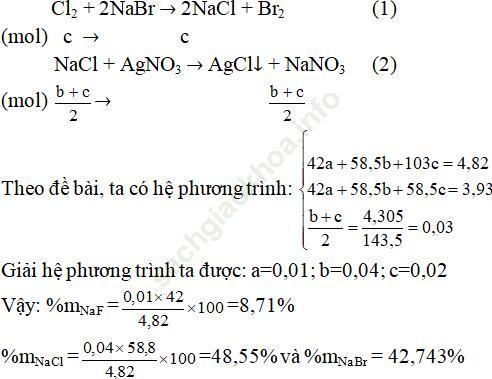
Câu 4. Cho 25 gam nước clo vào một dung dịch có chứa 2,5 gam KBr ta thấy dung dịch chuyển sang màu vàng.
a) Giải thích hiện tượng.
b) Cô cạn dung dịch sau thí nghiệm thì thu được 1,61 gam chất rắn khan. Giả sử toàn bộ clo trong nước clo đã tham gia phản ứng, hãy tính nồng độ phần trăm clo trong nước clo.
c) Tính khối lượng từng chất trong chất rắn khan thu được.
Đáp án:
Phản ứng: Cl2 + 2KBr → 2KCl + Br2 (1)
(gam) 2×119 2×74,5
Hiện tượng: Phản ứng tạo ra brom làm dung dịch có màu càng
Theo phản ứng (1): Cứ 1 mol Cl2 tham gia phản ứng thì khối lượng muối tan trong dung dịch giảm
2×119 - 2×74,5 = 89 (gam)
Theo đề bài, khối lượng muối giảm: 2,5 – 1,61 = 0,98 (gam)
nCl2 phản ứng = nmuối = 0.98 / 98 = 0,01 (mol)
Vậy nồng độ phần trăm của Cl trong nước clo:
(0,01.71)/25 ×100% = 2,84%
Từ (1) ⇒ nKCl = 2 × nCl2 = 2 × 0,01 = 0,02 (mol)
Vậy mKCl = 0,02 × 74,5 = 1,49 (gam); mKBr = 1,61 – 1,49 = 0,12 (gam)
Câu 5. Cho Cl2 dư tác dụng hoàn toàn với 50 gam hỗn hợp X (gồm NaCl và NaBr) thu được 41,1 gam muối khan Y. Tính % khối lượng của muối NaCl có trong X?
Ta có phương trình phản ứng xảy ra như sau:
Cl2 + NaBr → NaCl + Br2
nNaBr = (50-41,1)/ (80-35,5) = 0,2 mol
⇒ mNaBr = 0,2.103= 20,6 mol
⇒ mNaCl = 50-20,6 = 29,4 g
⇒ %NaCl = 29,4/50 = 58,8%.