Dạng 4: Kim loại tác dụng với Halogen -
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Một số lưu ý:
Khi kim loại tác dụng với các chất oxi hóa mạnh như F2, Cl2, Br2 sẽ được oxi hóa lên hóa trị cao nhất.
Ví dụ:
2Fe + 3Cl2 → 2FeCl3;
Fe + 2HCl → FeCl2 + H2
Ví dụ minh họa
Ví dụ 1. Cho 5,25 gam hỗn hợp bột Al và Mg vào dung dịch HCl dư, thu được 5,88 lít khí (đktc). Viết phương trình phản ứng xảy ra và tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu?
Bài giải:
Gọi a là số mol của Al và b là số mol của Mg

Ví dụ 2: Cho 4,8 g một kim loại R thuộc nhóm IIA tác dụng hết với dung dịch HCl thu được 4,48 lít khí H2 (đktc).
a) Viết phương trình phản ứng xảy ra và tính số mol hiđro thu được.
b) Xác định kim loại R.
c) Tính khối lượng muối khan thu được
Bài giải:
a, Phương trình phản ứng:
R + 2HCl → RCl2 + H2
nH2 = 4,48/22,4 = 0,2 mol
b, nR = nH2 = 0,2 mol
MR = 4,8/0,2 = 24 (Mg)
Vậy R là Mg
c, mMgCl2 = (24 + 71). 0,2 = 19g
Ví dụ 3: Để hoà tan hoàn toàn 8,1g một kim loại X thuộc nhóm IIIA cần dùng 450 ml dung dịch HCl 2M, thu được dung dịch A và V lít khí H2 (đktc).
a) Tìm X
b) Tính giá trị V.
c) Tính nồng độ mol của dung dịch A, xem như thể tích dung dịch thay đổi không đáng kể.
Bài giải:
a, Phương trình hóa học:
2X + 6HCl → 2XCl3 + 3H2
Ta có: nHCl = 0,45.2 =0,9 mol
⇒ nX = 0,9/3= 0,3 mol
MX = 8,1 /0,3 = 27 (Al)
b, nH2 = 1/2nHCl =0,45 mol
VH2 = 0,45.22,4 = 10,08 l
c, Dung dịch A là AlCl3
nAlCl3 = nX = 0,3 mol
CM = n/V = 0,3/0,45 = 0,67M
B. Bài tập trắc nghiệm
Câu 1. Lấy một lượng kim loại M tác dụng với khí Cl2 dư thu được 39 gam muối clorua. Cũng lượng kim loại đó tác dụng với dung dịch HCl dư, cô cạn dung dịch thu được 39,48 gam muối clorua khan. Xác định kim loại M?
Đáp án: M là Sắt
Gọi α là số mol kim loại M tham gia trong mỗi thí nghiệm.
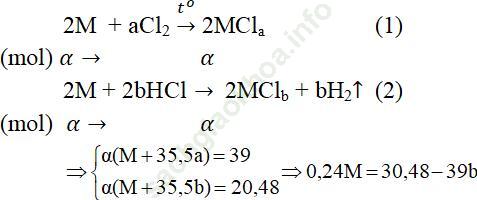
Bảng biện luận
| a | 1 | 1 | 2 | 2 | 3 | 3 |
| b | 1 | 2 | 1 | 3 | 2 | 1 |
| M | < 0 | < 0 | 91,5 | < 0 | 56 (Fe) | 218,5 |
| Loại | Loại | Loại | Loại | Nhận | Loại |
Câu 2. Cho 16,2 gam Al phản ứng vừa đủ với 90,6 gam hỗn hợp hai halogen thuộc hai chu kì liên tiếp nhau trong bảng tuần hoàn. Tìm tên của halogen đem dùng.
Đáp án:
Gọi công thức chung của hai halogen là: X−2 (gồm halogen A và B, giả sử MA < MB)
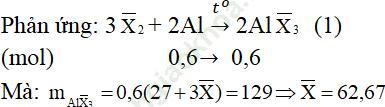
Suy ra: A là clo (35,5); B là brom (80)
Câu 3. Cho 2,8 gam kim loại M (chưa biết hóa trị) tác dụng với khí clo dư thu được 8,125 gam muối clorua.
a. Tìm kim loại M
b. Để hòa tan hết 8,4 gam kim loại M ở trên cần dùng bao nhiêu ml dung dịch HCl 20% (d = 1,1 g/ml)?
Đáp án:
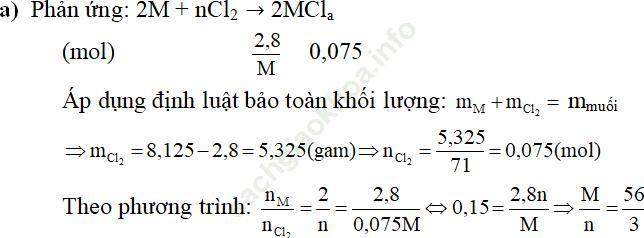
+) Nếu n = 1 ⇒ M = 18,67 (loại)
+) Nếu n = 2 ⇒ M = 37,33 (loại)
+) Nếu n = 3 ⇒ M = 56 (Kim loại M là Fe)

Câu 4. Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Tính thể tích khí Cl2 (ở đktc) đã phản ứng?
Đáp án:
Bảo toàn khối lượng:
mCl2 = mMuối − mKL = 28,4 gm
⇒ nCl2 = 0,4 mol ⇒ V = 8,96 (l)
Câu 5. Hỗn hợp khí A gồm clo và oxi. A phản ứng vừa hết với một hỗn hợp gồm 4,8 gam magie và 8,1 gam Al tạo ra 37,05 gam hỗn hợp các muối clorua và oxit của hai kim loại. Xác định thành phần phần trăm theo khối lượng và theo thể tích của hỗn hợp A.
Đáp án:
Các phương trình hóa học:
Mg + Cl2 → MgCl2 (1)
2Al + 3Cl2 → AlCl3 (2)
3Mg + O2 → 2MgO (3)
4Al + 3O2 → 2AlO3 (4)
Khối lượng hỗn hợp sau phản ứng tăng = khối lượng oxi và clo tham gia phản ứng:
37,05 – (4,80 + 8,10) = 24,15 (gam)
nMg = 4,8/24 = 0,2(mol); nAl = 8,1/27 = 0,3 (mol);
Gọi số mol O2 trong hỗn hợp là x, số mol Cl2 là y
Phương trình nhường e:
Al → Al3+ + 3e
Mg → Mg2+ + 2e
Tổng số mol e nhường là: 0,2 × 2 + 0,3 × 3 = 1,3 (mol)
Phương trình nhận e:
O2 + 4e → 2O2-
Cl2 + 2e → 2Cl-
Tổng số mol e nhận là: 4x + 2y
Số e nhường = số e nhận nên: 4x + 2y = 1,3 (*)
Khối lượng Cl2 và O2 tham gia phản ứng là 24,15 gam, ta có:
32x + 71y = 24,15 (**)
Kết hợp (*) và (**), ta có hệ phương trình:

Câu 6. Hòa tan 8,3 gam hỗn hợp gồm Al và Fe bằng dung dịch HCl dư, thu được 5,6 lít H2 (đktc) và dung dịch A.
a. Tính phần trăm theo khối lượng mỗi muối trong hỗn hợp ban đầu.
b. Tính thể tích dung dịch HCl 2M đã dùng biết đã dùng dư 10cm3 so với lí thuyết.
c. Dẫn khí Cl2 dư vào dung dịch A. Cô cạn dung dịch sau phản ứng thì thu được bao nhiêu gam muối khan.
Đáp án:
a)Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu:
Ta có: nH2 = 5,6/22,4 = 0,25 (mol)
Gọi a là số mol của Al và b là số mol của Fe
Phản ứng:
2Al + 6HCl → 2AlCl3 + 3H2 ↑ (1)
(mol) a → 3a 3a/2
Fe + 2HCl → FeCl2 + H2 ↑ (2)
(mol) b → 2b b
Gọi a là số mol của Al và b là số mol của Fe.
Theo đề bài, ta có hệ phương trình:

VHCl phản ứng = 0,5/2 = 0,25 (lít) = 250 (ml)
Vậy VHCl đã dùng = 250 + 10 = 260 (ml)
c) Khối lượng muối khan:
Cl2 + AlCl3 → không phản ứng
Cl2 + 2FeCl2 → 2FeCl3
(mol) 0,1 → 0,1
Khối lượng muối khan thu được là:
mmuối khan = mAlCl3 + mFeCl3 = 0,1 × (133,5 + 162,5) = 29,6 (gam)