Dạng 2: Nhận biết oxi, ozon, lưu huỳnh, SO2, SO3, H2S - Chuyên đề Hóa 10
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Hướng dẫn các bước làm một bài nhận biết:
Bước 1: Trích mẫu thử.
Bước 2: Dùng thuốc thử.
Bước 3: Nêu hiện tượng.
Bước 4: Viết phương trình phản ứng.
Chú ý: Nếu 2 mẫu thử có cùng tính chất, khi cho thuốc thử vào nhận biết thì hiện tượng sẽ trùng nhau, lúc đó ta tách chúng thành một nhóm, những mẫu thử khác không giống hiện tượng tách thành nhóm khác và tiếp tục sử dụng bảng nhận biết theo thứ tự như sau:
Bảng: Nhận biết O2, O3, S và các hợp chất
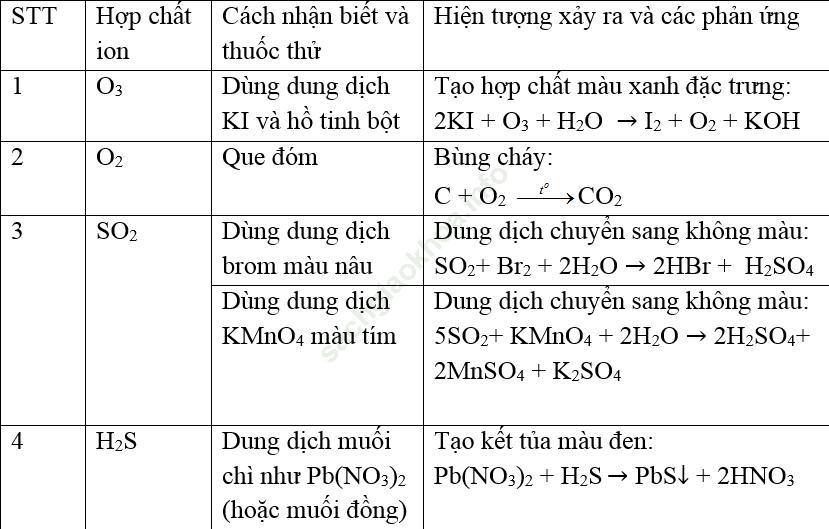
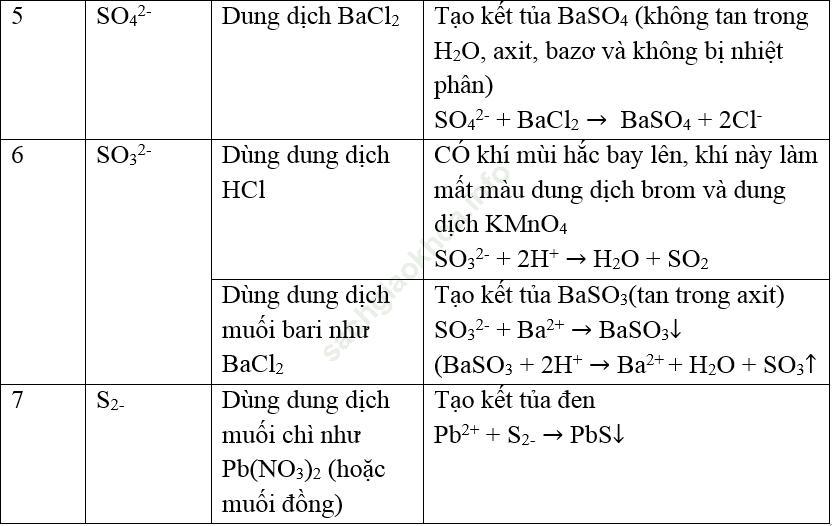
Ví dụ minh họa
Ví dụ 1: Có hai bình riêng biệt hai khí oxi và ozon. Trình bày phương pháp hóa học để phân biệt hai chất khí đó.
Bài giải:
Dẫn lần lượt hai khí đã cho vào 2 dung dịch KI (chứa sẵn một ít tinh bột) nếu dung dịch có màu xanh xuất hiện thì khí dẫn là ozon.
PTPƯ:
2KI + O3 + H2O → I2 + O2 + KOH
I2 + hồ tinh bột → xanh
Khí còn lại không làm đổi màu là khí oxi.
Ví dụ 2: Có 4 lọ, mỗi lọ đựng một dung dịch không màu gồm: NaCl, HCl, Na2SO4, Ba (NO3)2. Hãy nêu cách nhận biết các dung dịch đựng trong mỗi lọ bằng phương pháp hóa học. Viết phương trình hóa học xảy ra (nếu có).
Bài giải:
Trích mỗi dung dịch một ít làm mẫu thử.
- Cho quỳ tím lần lượt vào các mẫu thử, mẫu thử nào làm quỳ tím hóa đỏ là HCl. Ba mẫu thử còn lại không làm giấy quỳ đổi màu.
- Cho vài giọt dung dịch BaCl2 vào 3 mẫu thử còn lại, mẫu thử nào tạo kết tủa trắng là Na2SO4.
Na2SO4+ BaCl2 → NaCl + BaSO4↓
- Cho vài giọt dung dịch Na2SO4 (đã biết) vào 2 mẫu thử còn lại, mẫu nào có kết tủa trắng là dung dịch Ba (NO3)2
Na2SO4 + Ba (NO3)2 → 2NaNO3 + BaSO4↓
- Còn lại dung dịch NaCl, có thể khẳng định bằng dung dịch AgNO3
AgNO3 + NaCl → AgCl↓ + NaNO3
Ví dụ 3: Trình bày phương pháp hóa học nhận biết các dung dịch: Na2S, K2CO3, Na2SO3, NaCl, BaCl2,
Bài giải:
Trích mỗi dung dịch một ít làm mẫu thử.
- Cho dung dịch H2SO4 lần lượt vào các mẫu thử trên
+) Mẫu thử tạo kết tủa trắng là BaCl2
PTPƯ:
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
+) Mẫu thử tạo khí có mùi trứng ung (trứng thối) là Na2S
PTPƯ:
Na2S + H2SO4 → Na2SO4 + H2S↑
- Mẫu thử tạo khí mùi hắc là Na2SO3.
PTPƯ:
Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O
+) Mẫu thử tạo khí không màu, không mùi là K2CO3
PTPƯ:
K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O
+) Mẫu thử không có hiện tượng gì là NaCl.
Ví dụ 4: Cho các dung dịch không màu của các chất sau: NaCl, K2CO3. Na2SO4, HCl, Ba (NO3)2. Hãy phân biệt các dung dịch đã cho bằng phương pháp hóa học mà không dùng thêm hóa chất nào khác làm thuốc thử. Viết phương trình hóa học xảy ra (nếu có).
Bài giải:
Lấy mỗi dung dịch một ít rồi cho vào 5 ống nghiệm có đánh số.
- Cho lần lượt từng dung dịch vào các dung dịch còn lại, hiện tượng thí nghiệm được ghi trong bảng sau:
| NaCl | K2CO3 | Na2SO4 | HCl | Ba (NO32 | Kết luận | |
| NaCl | ||||||
| K2CO3 | ↑ | ↓ | ↑, ↓ | |||
| Na2SO4 | ↓ | ↓ | ||||
| HCl | ↑ | ↑ | ||||
| Ba (NO3)2 | ↓ | ↓ | 2↓ |
B. Bài tập trắc nghiệm
Câu 1. Có 4 lọ mất nhãn đựng bốn dung dịch K2SO3, K2SO4, (NH4)2SO3, (NH4)2SO4. Bằng phương pháp hóa học, hãy nhận biết các dung dịch đó.
- Trích mỗi dung dịch một ít làm mẫu thử cho mỗi thí nghiệm.
- Lần lượt nhỏ dung dịch HCl vào các mẫu thử.
+) Hai mẫu thử có khí bay ra K2SO3, (NH4)2SO4 (nhóm 1) theo phản ứng:
K2SO4 + 2HCl → 2KCl + H2O + SO2↑
(NH4)2SO3 + 2HCl → 2NH4Cl + SO2↑ +H2O
Hai mẫu thử còn lại không hiện tượng gì (nhóm 2).
- Nhỏ tiếp dung dịch NaOH lần lượt vào hai nhóm mẫu thử, mẫu thử có khí bay ra (NH4)2SO3 (đối với nhóm 1) và (NH4)2SO4 (đối với nhóm 2) theo phản ứng:
(NH4)2SO3 + 2NaOH → Na2SO3 + 2NH3↑ + 2H2O
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3↑ + 2H2O
=> chất còn lại ở mỗi nhóm.
Câu 2. Có 4 dung dịch A, B, C, D chứa các chất NaOH, HCl, H2SO4, H2O (không theo thứ tự trên). Lần lượt cho quỳ tím và dung dịch BaCl2 vào 4 dung dịch đó, quan sát hiện tượng thấy:
A: Quỳ tím hóa đỏ và tạo kết tủa trắng.
B: Quỳ tím hỏa xanh và không tạo kết tủa.
C: Quỳ tím không đổi màu và không tạo kết tủa.
D: Quỳ tím hóa đỏ và không tạo kết tủa.
Tìm A, B, C, D. Giải thích hiện tượng và viết phương trình phản ứng.
- A làm quỳ tím hóa đỏ và tạo kết tủa trắng => A là H2SO4
H2SO4 + BaCl2 → BaSO4 + 2HCl
- B làm quỳ tím hóa xanh và không tạo kết tủa là NaOH.
- C không đổi màu quỳ tím và không tạo kết tủa là H2O.
- D làm quỳ tím hóa đỏ và không tạo kết tủa là HCl.
Câu 3. Bằng phương pháp hóa học hãy nhận biết các khí sau: CO2, SO2, SO3.
- Cho qua dung dịch Br2 nhận biết SO2 do làm nhạt màu nâu của dung dịch brom:
Br2 + SO2 + 2H2O → 2HBr + H2SO4
- Cho qua dung dịch BaCl2 nhận biết SO3 do tạo kết tủa màu trắng:
BaCl2 + SO3 + H2O → BaSO4↓ + 2HCl
- Còn lại là CO2.
Câu 4. Làm thế nào để tinh chế khí H2 trong hỗn hợp khí CO2 + H2.
Cho hỗn hợp vào dung dịch Ca (OH)2 thì CO2 bị giữ lại do phản ứng:
CO2 + Ca (OH)2 → CaCO3 + H2O
Như vậy thu được H2.
Câu 5. Trình bày phương pháp hóa học để nhận biết các dung dịch: Na2S, K2CO3, BaCl2, Na2SO3, NaCl.
Trích mỗi dung dịch một ít làm mẫu thử
Cho dung dịch H2SO4 lần lượt vào các mẫu thử trên
- Mẫu thử tạo kết tủa trắng là BaCl2
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
- Mẫu thử không có hiện tượng gì là NaCl
- Mẫu thử tạo khí có mùi trứng ung (trứng thối) là Na2S
Na2S + H2SO4 → Na2SO4 + H2S↑
- Mẫu thử tạo khí mùi hắc là Na2SO3.
Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O
- Mẫu thử tạo khí không màu, không mùi là K2CO3
K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O
Lưu ý: Nếu không nhận biết được bằng mùi khí H2S và SO2 thì có thể phân biệt ba khí bằng cách sau:
- Dẫn 3 khí lần lượt qua dung dịch CuSO4, khí tạo kết tảu màu đen là H2S.
H2S + CuSO4 → CuS↓ (đen) + H2SO4
- Dẫn hai khí còn lại qua dung dịch nước brom, khí nào làm mất màu nước brom là SO2:
SO2 + Br2 + 2H2O → 2HBr + H2SO4
- Khí còn lại là CO2
Câu 6. Cho các dung dịch không màu của các chất sau: NaCl, K2CO3. Na2SO4, HCl, Ba (NO3)2. Hãy phân biệt các dung dịch đã cho bằng phương pháp hóa học mà không dùng thêm hóa chất nào khác làm thuốc thử. Viết phương trình hóa học xảy ra (nếu có).
Lấy mỗi dung dịch một ít rồi chia ra 5 ống nghiệm có đánh số. Cho lầ lượt từng dung dịch vào các dung dịch còn lại, hiện tượng thí nghiệm được ghi trong bảng sau:
| NaCl | K2CO3 | Na2SO4 | HCl | Ba (NO3)2 | Kết luận | |
| NaCl | ||||||
| K2CO3 | ↑ | ↓ | ↑, ↓ | |||
| Na2SO4 | ↓ | ↓ | ||||
| HCl | ↑ | ↑ | ||||
| Ba (NO3)2 | ↓ | ↓ | 2↓ |
Nhận xét:
Ở dung dịch nào không có hiện tượng gì thì đó là dung dịch NaCl
- Dung dịch nào có 1 trường hợp thoát khí và 1 trường hợp kết tủa là K2CO3:
K2CO3 + 2HCl → 2KCl + H2O + CO2↑ (1)
K2CO3 + Ba (NO3)2 → KNO3 + BaCO3↓ (2)
- Dung dịch có 1 tường hợp kết tủa là dung dịch Na2SO4
Na2SO4 + Ba (NO3)2 → 2NaNO3 + BaSO4↓ (3)
- Dung dịch nào có 1 trường hợp thoát khí là dung dịch HCl (phương trình (1)).
- Dung dịch nào có 2 trường hợp kết tủa là dung dịch Ba (NO3)2 (phương trình (2) và (3)).