Bài 45: Luyện tập: Tính chất của crom, sắt và những hợp chất của chúng - Giải BT Hóa học 12 nâng cao
Bài 1 (trang 222 sgk Hóa 12 nâng cao): Cho phương trình hóa học:
2Cr + 3Sn2+ → 2Cr3+ + 3Sn
Câu nào diễn tả đúng vai trò các chất?
A. Cr là chất oxi hóa, Sn2+ là chất khử.
B. Cr là chất khử, Sn2+ là chất oxi hóa.
C. Sn2+ là chất khử, Cr3+ là chất oxi hóa.
D. Cr3+ là chất khử, Zn2+ là chất oxi hóa.
Bài giải:Đáp án đúng là: B
Trong phương trình trên Cr là chất khử, Sn2+ là chất oxi hóa.
Bài 2 (trang 222): Kim loại trong cặp oxi hóa khử nào sau đây có thể phản ứng với ion Ni2+ trong cặp Ni2+/Ni?
A. Pb2+/Pb
B. Cu2+/Cu
C. Sn2+/Sn
D. Cr3+/Cr
Bài giải:Đáp án đúng là: D
Bài 3 (trang 222): Trong phản ứng: Fe + H2SO4 → Fe2(SO4)3 + H2O + SO2 có bao nhiêu nguyên tử Fe bị oxi hóa và bao nhiêu nguyên tử H2SO4 bị khử?
A. 2 và 3
B. 1 và 1
C. 3 và 2
D. 2 và 6
Bài giải:Đáp án đúng là: A
Bài 4 (trang 222): Viết các phương trình hóa học cho những chuyển đổi sau:
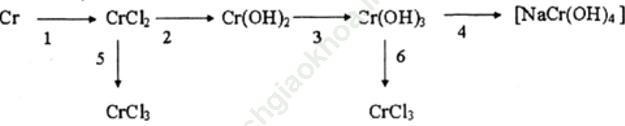
1) Cr + 2HCl → 2CrCl2 + H2
2) CrCl2 + 2NaOH → Cr (OH)2 + 2NaCl
3) 4Cr (OH)2 + 2H2O + O2 → 4Cr (OH)3.
4) Cr (OH)3 + NaOH → Na [Cr (OH)4]
5) 2CrCl2 + Cl2 → 2CrCl3
6) Cr (OH)3 + 3HCl → CrCl3 + 3H2O
Bài 5 (trang 222): Sự ăn mòn sắt, thép là một quá trình oxi hóa – khử.
a. Giải thích và viết phương trình hóa học của phản ứng xảy ra khi sắt thép bị ăn mòn.
b. Kẽm hoặc thiếc tráng ngoài vật bằng sắt, thép có tác dụng bảo vệ chống ăn mòn. Hãy giải thích một thực tế là sau một thời gian sử dụng thì vật được tráng bằng kẽm lại có hiệu quả bảo vệ tốt hơn.
c. Tại sao thiếc lại được dùng nhiều hơn kẽm để bảo vệ những đồ hộp đựng thực phẩm. Còn lại kẽm lại được dùng nhiều hơn để bảo vệ ống dẫn nước, xô, chậu... ?
Bài giải:a. Sự ăn mòn sắt thép là quá trình ăn mòn điện hóa với anot bị ăn mòn là sắt, catot là cacbon.
Tại anot:
Fe → Fe2+ + 2e
Fe2+→ Fe3+ + e
Tại catot:
2H2O + 2e → 2OH- + H2
Sau đó Fe2+ + 2OH-→ Fe (OH)2
Fe3+ + 32OH- → Fe (OH)3
Fe (OH)2, Fe (OH)3 → Fe2O3.nH2O (Gỉ sắt)
b. Tráng kẽm, thiếc ngoài vật bằng sắt, thép thì kẽm có hiệu quả bảo vệ tốt hơn là vì:
- Kẽm là kim loại có tính khử mạnh hơn sắt, nếu xảy ra hiện tượng ăn mòn thì kẽm bị ăn mòn trước.
- Thiếc là kim loại có tính khử yếu hơn sắt, nếu xảy ra hiện tượng ăn mòn thì sắt bị ăn mòn trước.
c. Thiếc được dùng nhiều hơn kẽm trong việc sản xuất đồ hộp thực phẩm bởi vì các hợp chất của thiếc an toàn hơn, không gây độc cho con người như hợp chất của kẽm.
Tuy nhiên, để bảo vệ ống nước, xô, chậu, mái tôn thì kẽm được ưu tiên hơn thiếc vì kẽm bảo vệ sắt chống ăn mòn điện hóa tốt hơn thiếc.
Bài 6 (trang 223):
a. Từ Fe hãy trình bày 3 phương pháp điều chế trực tiếp muối FeSO4.Viết các phương trình hóa học.
b. Từ hỗn hợp Ag và Cu, hãy trình bày 3 phương pháp hóa học tách riêng Ag và Cu. Viết các phương trình hóa học.
Bài giải:a. Fe + H2SO4 loãng → FeSO4 + H2
Fe + CuSO4 → FeSO4+ Cu
Fe + Fe2(SO4)3 → 3FeSO4
b. 3 phương pháp tách riêng Ag và Cu từ hỗn hợp:
Hòa tan hỗn hợp bằng muối Fe (III); Cu tan còn Ag không tan, tách riêng Cu:
Cu + 2Fe3+→ Cu2++ 2Fe2+
Cho sắt kim loại vào dung dịch thu được đồng.
Fe + Cu2+ → Fe2+ + Cu
Phương pháp 2:
- Hòa tan hỗn hợp vào dung dịch HNO3 loãng dư thu được dung dịch.
3Cu + 8HNO3 → 3Cu (NO3)2 + 2NO↑ + 4H2O
Ag + 4HNO3 → 3AgNO3 + NO↑ + 2H2O
- Cô cạn dung dịch, nhiệt phân hỗn hợp muối thu được chất rắn.
2AgNO3⟶ 2Ag + O2↑ + 2NO2↑
2Cu (NO3)2 ⟶ 2CuO + O2↑ + 4NO2↑
- Hòa tan chất rắn thu được (CuO, Ag) vào dung dịch HCl dư lọc thu được chất rắn Ag và dung dịch CuCl2. Tiến hành điện phân dung dịch CuCl2 thu được Cu.
CuO + 2HCl → CuCl2 + H2O.
CuCl2 ⟶ Cu + Cl2.
Phương pháp 3:
- Đốt hỗn hợp bằng O2, Cu phản ứng còn Ag thì không:
2Cu + O2 → 2CuO
- Hòa tan hỗn hợp chất rắn sau phản ứng vào dung dịch HCl dư lọc thu được chất rắn Ag và dung dịch CuCl2. Tiến hành điện phân dung dịch CuCl2 thu được Cu.
CuO + 2HCl → CuCl2 + H2O;
CuCl2 ⟶ Cu + Cl2
Bài 7 (trang 223): Có 3 lọ, mỗi lọ đựng một trong 3 hỗn hợp sau: Fe và FeO; Fe và Fe2O3: FeO và Fe2O3. Hãy dẫn ra cách nhận biết hỗn hợp chất đựng trong mỗi lọ bằng phương pháp hóa học và viết các phương trình hóa học.
Bài giải:- Lấy chất trong từng lọ đem hòa tan bằng dung dịch HCl nhận ra hỗn hợp có chứa FeO và Fe2O3 và tan nhưng không sinh ra khí. 2 hỗn hợp kia tan và kèm theo hiện tượng thoát khí:
FeO + 2HCl → FeCl2 + H20
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Fe + 2HCl → FeCl2 + H2 ↑
- Lấy phần dung dịch của hai hỗn hợp chưa nhận được, nhỏ từ từ dung dịch NaOH vào
+ Nhận ra hỗn hợp ban đầu là Fe và FeO do tạo dung dịch FeCl2 khi tác dụng với NaOH tạo ra kết tủa màu trắng xanh.
FeCl2 + 2NaOH → Fe (OH)2 + 2NaCl
+ Nhận ra hỗn hợp ban đầu là Fe và Fe2O3 do tạo dung dịch hỗn hợp FeCl2 và FeCl3 khi tác dụng với NaOH tạo kết tủa trắng xanh lẫn nâu đỏ.
FeCl2 + 2NaOH → Fe (OH)2 ↓ + 2NaCl
FeCl2 + 3NaOH → Fe (OH)3 ↓ nâu đỏ + 3NaCl
Bài 8 (trang 223): Khử 2,4 gan hỗn hợp CuO và một oxit sắt có tỉ lệ số mol 1: 1. Sau phản ứng thu được 1,76 gam chất rắn, đcm hòa tan vào dung dịch HCl dư thấy thoát ra 0,448 lít khí (đktc). Xác định công thức của oxit sắt.
Bài giải:Sản phẩm khử CuO và oxi săt là Cu và Fe với tổng khối lượng hai kim loại là 1,76 gam
Fe + 2HCl → FeCl2 + H2
nFe = nH2 = 0,448: 22,4 = 0,02 mol
⇒ mFe = 0,02.56 = 1,12 ⇒ mCu = 1,76 – 1,12 = 0,64 gam
nCu = 0,01 mol = nCuO
Trong hỗn ban đẩu có 0,01 mol CuO chiếm 0,8 gam
0,01 mol FexOy chiếm 1,6 gam
mFexOy = 1,6: 0,01 = 160 ⇒ Oxit sắt là Fe2O3
Bài 9 (trang 223): Dung dịch A là FeSO4 có lẫn tạp chất Fe2(SO4)3. Để xác định nồng độ mol của mỗi chất trong dung dịch A, người ta tiến hành những thí nghiệm sau:
Thí nghiệm 1: Thêm dần dần dung dịch NaOH vào 20ml dung dịch A cho đến dư, đun nóng. Lọc lấy kết tủa, nung ở nhiệt độ cao đến khi khối lượng không đổi, được chất rắn duy nhất có khối lượng 1,2 gam.
Thí nghiệm 2: Thêm vài giọt dung dịch H2SO4 vào 20 ml dung dịch A, rồi nhỏ dần dần từng giọt dung dịch KMnO4 vào dung dịch trên lắc nhẹ. Khi đun dung dịch có màu hồng thì ngừng thí nghiệm, người ta đã dùng hết 10 ml dung dịch KMnO4 0,2 M.
a. Giải thích quá trình thí nghiệm và viết các phương trình hóa học.
b. Tính nồng độ mol của mỗi chất có trong dung dịch A ban đầu.
c. Bằng phương pháp hóa học nào có thể loại bỏ được tạp chất trong dung dịch A ban đầu. Viết phương trình hóa học của phản ứng đã dùng.
Bài giải:a. Thí nghiệm 1:
FeSO4 + 2NaOH → Fe (OH)2 + Na2SO4 (1)
Fe2(SO4)3 + 6NaOH → 2Fe (OH)3 + 3NaCl (2)
Thí nghiệm 2:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O (5)
nFeSO4 = 5nKMnO4 = 5.0,01.0,2 = 0,01 mol
Theo các phương trình hóa học (1,3) ⇒ nFe2O3 (3) = 1/2. nFeSO4 = 0,005
⇒ nFe2(SO4)3 ban đầu = nFe2O3 – nFe2O3 (3) = 1,2/160 - 0,005 = 0,0025 mol
b. Xác định nồng độ mol
CM FeSO4 = 0,01/0,02 = 0,5 M
CM Fe2(SO4)3 = 0,0025/0,02 = 0,125 M
c. Ngâm một đinh sắt vào A sẽ loại được Fe2(SO4)3
Fe + Fe2(SO4)3 → 3FeSO4
Bài trước: Bài 44: Sơ lược về một số kim loại khác - Giải BT Hóa học 12 nâng cao Bài tiếp: Bài 46: Luyện tập: Tính chất của đồng và hợp chất của đồng. Sơ lược về các kim loại Ag, Au, Ni, Zn, Sn, Pb - Giải BT Hóa học 12 nâng cao