Bài 39: Một số hợp chất của crom - Giải BT Hóa học 12 nâng cao
Bài 1 (trang 194 sgk Hóa 12 nâng cao): Có nhận xét gì về tính chất hóa học của các hợp chất Cr (II), Cr (III) và Cr (VI)? Dẫn ra những phản ứng hóa học để chứng minh.
Bài giải:Cr (II) có tính khử mạnh:
2CrCl2 + Cl2 → 2CrCl3
Cr (III) vừa có tính oxi hóa vừa có tính khử.
2CrCl3 + Zn → 2CrCl2 + ZnCl2
2CrCl3 + 3Cl2 + 16NaOH → 2Na2CrO4 + 12NaCl + 8H2O
Cr (VI) có tính oxi hóa mạnh.
2CrO3 + 2NH3 → Cr2O3 + N2 + 3H2O
Bài 2 (trang 194): Có các sơ đồ phản ứng sau:
a. K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O + S
b. K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O
c. K2Cr2O7 + FeSO4 → Cr2(SO4)3 + K2SO4 + H2O+ Fe2(SO4)3
1) Lập các phương trình phản ứng hóa học cho những phản ứng trên.
2) Cho biết vai trò các chất tham gia phản ứng.
Bài giải:a. K2Cr2O7 + 3H2S + 4H2SO4 → Cr2(SO4)3 + K2SO4 + 7H2O + 3S
K2Cr2O7: là chất oxi hóa
H2S: là chất khử
H2SO4: là môi trường
b. K2Cr2O7 + 14HCl → 2CrCl3 + 3Cl2 + 2KCl + 7H2O
K2Cr2O7: là chất oxi hóa
HCl: vừa là chất khử, vừa là môi trường.
c. K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + K2SO4 + 7H2O + 3Fe2(SO4)3
K2Cr2O7: là chất oxi hóa
Fe2+: là chất khử
H2SO4: là môi trường
Bài 3 (trang 194): Người ta có thể điều chế Cr (III) oxit bằng cách phân hủy muối amoni đicromat ở nhiệt độ cao:
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
Hãy cho biết phản ứng trên thuộc loại phản ứng nào và lập phương trình hóa học.
Bài giải:(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
2N-3 → N2o + 6e
N-3 là chất khử
2Cr+6 + 6e → 2Cr+3
Cr+6 là chất oxi hóa
Đây là phản ứng phân hủy.
Bài 4 (trang 194): Viết phương trình oxi hóa - khử (dạng phân tử và ion rút gọn) giữa kali đicròmat và natri sunfua khi có mặt axit sunfuric. Biết rằng, trong phản ứng này có sự biến đổi số oxi hóa.
Bài giải:K2Cr2O7 + 3Na2S + 7H2SO4 → K2SO4 + Cr2(SO4)3 + 3Na2SO4 + 3S + 7H2O
Phương trình ion:
Cr2O72- + 3S2- + 14H+ → 2Cr3+ + 3S + 7H2O
Bài 5 (trang 194): Muối Cr (III) tác dụng với chất oxi hóa mạnh trong môi trường kiềm tạo thành muối Cr (VI).
a. Hãy lập phương trình hóa học của phán ứng sau:
CrCl3 + Cl2 + NaOH → Na2CrO4 + NaCl + H2O
Và cho biết vai trò các chắt CrCl3 và Cl2 trong phản ứng. Giải thích?
b. Muối Cr (III) tác dụng với chất khử tạo thành muối Cr (II). Hãy lập phương trình của phản ứng sau:
CrCl3 + Zn → CrCl2 + ZnCl2
và cho biết vai trò các chất CrCl3 và Zn.
c. Hãy cho kết luận về tính chất hóa học của muối Cr (III).
Bài giải: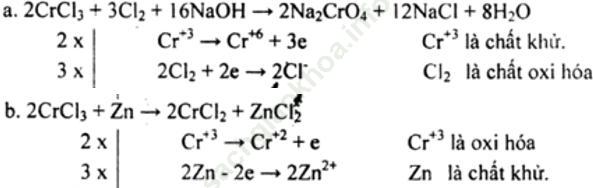
Muối Cr (III) vừa có tính oxi hóa vừa có tính khử
Sản phẩm oxi hóa Cr (III) là Cr (VI)
Sản phẩm khử Cr (III) là Cr (II)