Bài 29: Một số hợp chất quan trọng của kim loại kiềm - Giải BT Hóa học 12 nâng cao
Bài 1 (trang 157 sgk Hóa 12 nâng cao): Trong quá trình điện phân dung dịch NaCl, ở cực âm xảy ra:
A. Sự khử ion Na+
B. Sự oxi hóa Na+
C. Sự khử phân tử H2O
D. Sự oxi hóa phân tử H2O
Bài giải:Đáp án đúng là: C
Trong quá trình điện phân dung dịch NaCl, ở cực âm xảy ra sự khử phân tử H2O.
Bài 2 (trang 157): Trong quá trình điện phân dung dịch KBr, phản ứng nào sau đây xảy ra ở cực dương (anot)?
A. Ion Br- bị oxi hóa
B. Ion Br- bị khử
C. Ion K+ bị oxi hóa
D. Ion K+ bị khử
Bài giải:Đáp án đúng là: A
Trong quá trình điện phân dung dịch KBr, phản ứng xảy ra ở cực dương (anot) là Ion Br- bị oxi hóa.
Bài 3 (trang 157): Cho 3,1 gam hỗn hợp 2 kim loại kiềm ở hai chu kỳ liên tiếp trong bảng tuần hoàn tác dụng hết với nước thu được 1,12 lít khí H2 (đktc).
a) Xác định tên 2 kim loại kiềm và tính % khối lượng mỗi kim loại trong hỗn hợp.
b) Tính thể tích dung dịch HCl cần dùng để trung hòa dung dịch kiềm trên và khối lượng muối clorua thu được.
Bài giải:a) Đặt công thức chung cho 2 kim loại kiềm là M. Ta có PTPƯ:
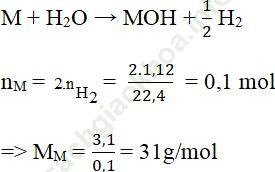
Vậy 2 kim loại kiềm liên tiếp là Na (23) và K (39)
Theo sơ đồ đường chéo, ta có:
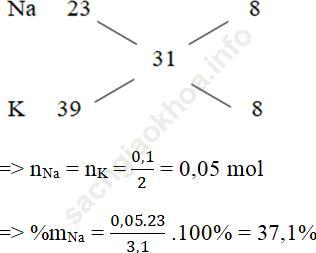
⇒ %mK = 100 – 37,1 = 62,9%
b) Phản ứng trung hòa
MOH + HCl → MCl + H2O
nHCl = nMOH = 0,1 mol
⇒ VHCl 2M = 0,1/2 = 0,05 lít = 50 ml
Khối lượng muối: mMCl = 0,1. (M + 35,5) = 6,65 gam
Bài 4 (trang 157): Cho 3,9 gam kim loại K tác dụng với 101,8 gam nước. Tính nồng độ mol và nồng độ % của chất trong dung dịch thu được. Biết khối lượng riêng của dung dịch đó là 1,056 g/ml.
Bài giải:nK = 3,9/39 = 0,1 mol
Phản ứng: 2K + 2H2O → 2KOH + H2
nH2 = 0,05.2 = 0,1 gam
Khối lượng dung dịch sau phản ứng:
mdd = 3,9 + 101,8 – 0,1 = 105,6 gam
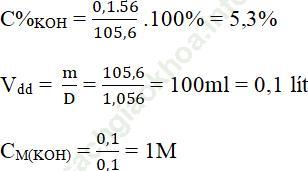
Bài 5 (trang 157): So sánh tính chất hóa học của 2 muối NaHCO3 và Na2CO3. Viết các phương trình hóa học minh hoạ.
Bài giải:Hai muối Na2CO3 và NaHCO3
- Đều là muối của axit yếu, có khả năng nhận proton thể hiện tính bazo:
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
CO32- + 2H+ → CO2 + H2O
NaHCO3 + HCl → NaCl + CO2 + H2O
HCO3- + H+ → CO2 + H2O
- NaHCO3 là muối axit tác dụng với bazo tạo muối trung hòa:
NaHCO3 + NaOH → Na2CO3 + H2O
HCO3- + OH- → CO32- + H2O
Vậy NaHCO3 là muối có tính lưỡng tính. Còn Na2CO3 là muối có tính chất bazo.
Bài 6 (trang 157): Nung 4,84g hỗn hợp NaHCO3 và KHCO3 đến phản ứng hoàn toàn thu được 0,56 lít CO2 (đktc). Xác định khối lượng của mỗi muối trong hỗn hợp trước và sau khi nung.
Bài giải:Đặt số mol NaHCO3 và KHCO3 là x, y
⇒ 84x + 100y = 4,84 (1)
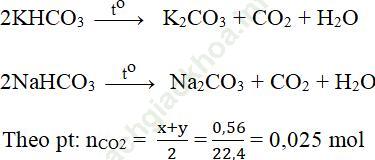
⇒ x + y = 0,05 (2)
Từ (1), (2) ⇒ x = 0,01; y = 0,04
Vậy khối lượng NaHCO3 là 0,01.84 = 0,84 gam
KHCO3 là 0,04.100 = 4,00 gam
Bài trước: Bài 28: Kim loại kiềm - Giải BT Hóa học 12 nâng cao Bài tiếp: Bài 30: Kim loại kiềm thổ - Giải BT Hóa học 12 nâng cao