Bài 22: Sự điện phân - Giải BT Hóa học 12 nâng cao
Bài 1 (trang 131 sgk Hóa 12 nâng cao): Phản ứng nào xảy ra ở catot trong quá trình điện phân MgCl2 nóng chảy?
A. Sự oxi hóa ion Mg2+
B. Sự khử ion Mg2+
C. Sự oxi hóa ion Cl-
D. Sự khử ion Cl-
Bài giải:Đáp án đúng là: B
Giải thích: Phản ứng khử ion Mg2+ xảy ra ở catot trong quá trình điện phân MgCl2 nóng chảy.
Bài 2 (trang 131): Trong quá trình điện phân KBr nóng chảy, phản ứng nào xảy ra ở điện cực dương (anot)?
A. Ion Br- bị khử
B. Ion Br- bị oxi hóa
C. Ion K+ bị khử
D. Ion K+ bị oxi hóa
Bài giải:Đáp án đúng là: B
Giải thích:
Trong quá trình điện phân KBr nóng chảy, phản ứng Ion Br- bị oxi hóa xảy ra ở điện cực dương (anot).
Bài 3 (trang 131): Phản ứng nào sau đây xảy ra ở catot trong quá trình điện phân?
a. Cu2+(dd) + 2e → Cu (r)
b. Cu (r) → Cu2+(dd) + 2e
c. 2H2O + 2e → H2 +2OH-(dd)
d. 2H2O → O2 + 4H+ + 4e
e. 2Br-(dd) → Br2(dd) + 2e
Bài giải:– Catot (cực âm) là nơi xảy ra sự khử, các cation và phân tử nhận electron ở đây.
⇒ Phản ứng a, c đều xảy ra ở catot.
Bài 4 (trang 131): Hãy giải thích:
a. Khi điện phân KCl nóng chảy và khi điện phân dung dịch KCl thì sản phẩm thu được là khác nhau.
b. Khi điện phân dung dịch KNO3, dung dịch H2SO4 thì sản phẩm thu được là giống nhau.
Bài giải:a,
- Điện phân KCl nóng chảy:
Catot (-) ← KCl nóng chảy → Anot (+)
K+ Cl-
K+ + e → K
2Cl- → Cl2 + 2e
Phương trình điện phân: ![]()
- Điện phân dung dịch KCl
Catot (-) ← KCl dung dịch → Anot (+)
K+, H2O Cl-,H2O
2H2O +2e → H2 + 2OH-(dd)
2Cl- → Cl2 + 2e
Phương trình điện phân: ![]()
Sự khác nhau về sản phẩm điện phân KCl nóng chảy và dung dịch KCl trong nước là quá trình khử ion K+ và khử H2O tương ứng.
b.
- Điện phân dung dịch KNO3
Catot (-) ← KNO3 dung dịch → Anot (+)
K+, H2O NO3-, H2O
2H2O + 2e → H2 + 2OH-(dd)
2H2O → O2 + 4H+ + 4e
Phương trình điện phân: ![]()
- Điện phân dung dịch H2SO4
Catot (-) ← KCl dung dịch → Anot (+)
H+, H2O SO42-, H2O
2H+ + 2e → H2 2H2O → O2 + 4H+ + 4e
Phương trình điện phân: ![]()
Sự giống nhau về sản phẩm điện phân KNO3 và dung dịch H2SO4 trong nước là vì thực chất đều là phản ứng điện phân nước.
Bài 5 (trang 131): Điện phân một dung dịch chứa anion NO3- và các cation kim loại có cùng nồng độ mol: Cu2+, Ag2+, Pb2+. Hãy cho biết trình tự xảy ra sự khử của các ion kim loại này trên bề mặt catot. Giải thích?
Bài giải:Tính oxi hóa Ag+ > Cu2+ > Pb2+ ⇒ Trình tự xảy ra sự khử ở catot là:
Ag+ + e → Ag
Cu2+ + 2e → Cu
Pb2+ + 2e → Pb
Bài 6 (trang 131): Sau một thời gian điện phân 200 ml dung dịch CuSO4 với điện cực graphit, khối lượng dung dịch giảm 8 gam. Để kết tủa ion Cu2+ còn lại trong dung dịch sau điện phân cần dùng 100 ml dung dịch H2S 0,5M. Hãy xác định nồng độ % của dung dịch CuSO4 trước điện phân. Biết dung dịch CuSO4 ban đầu có khối lượng riêng là 1,25 g/ml.
Bài giải:Ta có: nH2S = 0,5.0,1 = 0,05 mol
Gọi số mol CuSO4 bị điện phân là a.
Các phương trình phản ứng xảy ra như sau:
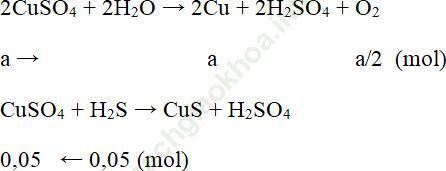
Sau điện phân khối lượng dung dịch giảm do Cu kết tủa và O2 bay hơi
Số mol CuSO4 ban đầu là a + 0,05 = 0,1 + 0,05 = 0,15 mol
CM (CuSO4) = 0,15/0,2 = 0,75 M