Bài 27: Bài thực hành 4: Ăn mòn kim loại. Chống ăn mòn kim loại - Giải BT Hóa học 12 nâng cao
Thí nghiệm 1: Ăn mòn điện hóa học
- Tiến hành Thí nghiệm:
+ Rót các thể tích dung dịch NaCl đậm đặc bằng nhau vào 2 cốc thủy tinh.
+ Cắm 1 lá sắt và 1 lá đồng vào mỗi cốc.
+ Nhỏ vào mỗi cốc 5-7 giọt dung dịch K3[Fe (CN)6]
+ Nối lá Fe và lá Cu trong 2 cốc bằng dây dẫn (hình 5.16)
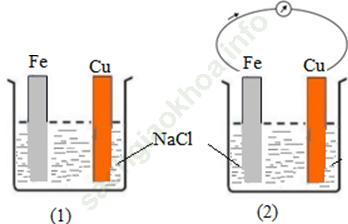
Hình 5.16: Thí nghiệm ăn mòn điện hóa học kim loại sắt
- Hiện tượng:
+ Cốc 1: Không có hiện tượng gì.
+ Cốc 2: Xuất hiện kết tủa màu xanh đậm.
- Giải thích: Khi nối dây dẫn, Fe bị ăn mòn nhanh trong dung dịch điện li tạo thành Fe2+. Sau đó Fe2+ tác dụng với dd K3[Fe (CN)6] tạo ra kết tủa màu xanh đậm là Fe3[Fe (CN)6]2
Trong cốc 2:
Ở cực (+) xảy ra sự khử:
O2 + 2H2O + 4e → 4OH-
Ở cực (-), Fe bị ăn mòn và tan vào dịch:
Fe → Fe2+ + 2e
Thí nghiệm 2: Bảo vệ sắt bằng phương pháp bảo vệ điện hóa
- Tiến hành Thí nghiệm:
+ Rót vào hỗn hợp gồm dung dịch NaCl đặc, thêm vài giọt dung dịch K3[Fe (CN)6] vào 2 cốc.
+ Ngâm 1 đinh sắt vào cốc (1), ngâm 1 đinh sắt được quấn bằng dây Zn vào cốc (2).
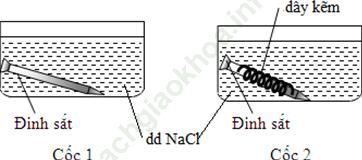
- Hiện tượng:
+ Cốc 1: Xuất hiện kết tủa màu xanh.
+ Cốc 2: Lá Zn bị ăn mòn, dung dịch không đổi màu.
- Giải thích:
+ Cốc 1: Đinh Fe bị oxi hóa thành Fe2+; Fe2+ tác dụng với dung dịch K3[Fe (CN)6] tạo ra kết tủa màu xanh đậm là Fe3[Fe (CN)6]2
+ Cốc 2: Zn có tính khử mạnh hơn nên đóng vai trò là cực âm và bị ăn mòn. Dây Zn bị ăn mòn, Fe được bảo vệ nên dung dịch không đổi màu.
Ở cực (-): Zn → Zn2+ + 2e
Ở cực (+): H2O + O2 + 4e → 4OH-
Bài trước: Bài 26: Bài thực hành 3: Dãy điện hóa của kim loại. Điều chế kim loại - Giải BT Hóa học 12 nâng cao Bài tiếp: Bài 28: Kim loại kiềm - Giải BT Hóa học 12 nâng cao