Bài 26: Bài thực hành 3: Dãy điện hóa của kim loại. Điều chế kim loại - Giải BT Hóa học 12 nâng cao
Thí nghiệm 1: Suất điện động của các pin điện hóa Zn - Cu và Zn - Pb
a) Pin điện hóa Zn - Cu
- Tiến hành thí nghiệm:
+ Lắp pin điện hóa theo sơ đồ hình 5.3
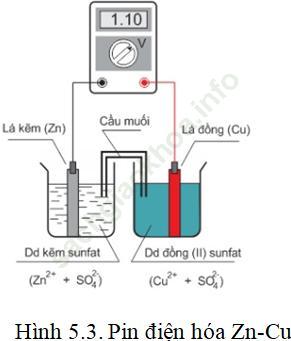
+ Nhúng lá Zn vào cốc đựng dung dịch ZnSO4 1M, nhúng lá Cu vào cốc đựng dung dịch CuSO4 1M
+ Nối 2 dung dịch muối trong 2 cốc bằng cầu nối đựng dung dịch NH4NO3
+ Nối 2 điện cực với vôn kế, điện cực Zn ở bên trái và điện cực Cu ở bên phải.
- Số liệu: Suất điện động của pin điện hóa Zn-Cu đo được là 1,1V.
b) Pin điện hóa Zn - Pb -
Tiến hành thí nghiệm:
+ Lắp pin điện hóa Zn - Pb tương tự như sơ đồ của pin điện hóa Zn - Cu
+ Nhúng lá Zn vào cốc đựng dung dịch ZnSO4 1M, nhúng lá Cu vào cốc đựng dung dịch Pb (NO3) 1M.
+ Nối 2 dung dịch muối trong 2 cốc bằng cầu nối đựng dung dịch NH4NO3
+ Nối 2 điện cực với vôn kế, điện cực Zn ở bên trái và điện cực Pb ở bên phải.
- Số liệu: Suất điện động của pin điện hóa Zn - Pb đo được là 0,63V
⇒ Suất điện động của pin điện hóa Zn - Cu lớn hơn của pin điện hóa Zn-Pb
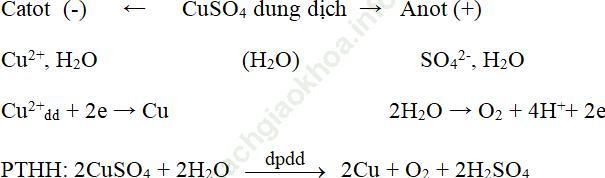
Thí nghiệm 2: Điện phân dung dịch CuSO4, các điện cực bằng graphit
- Tiến hành thí nghiệm:
+ Lắp dụng cụ điện phân dung dịch CuSO4 như hình sau:
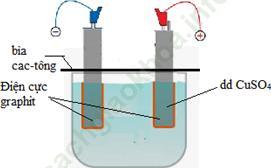
+ Điều chỉnh dòng điện đi qua vào dung dịch
- Hiện tượng:
+ Ở cực (-) xuất hiện kim loại màu đỏ bám trên catot
+ Ở cực (+) xuất hiện bọt khí
- Giải thích: Khi có dòng điện:
+ Ở cực (+) xảy ra sự oxi hóa H2O sinh ra khí O2
+ Ở cực (-) xảy ra sự khử Cu2+ thành Cu
Sơ đồ điện phân: