Phương pháp bảo toàn electron trong hóa học hay, chi tiết, có lời giải - Chuyên đề Hóa 12
Phương pháp giải
1. Nội dung
Trong phản ứng oxi hóa khử:
+) Số electron nhường = Số electron nhận.
+) Số mol electron nhường = Số mol electron nhận.
2. Phạm vi sử dụng
+ Chủ yếu áp dụng cho bài toán oxi hóa khử các chất vô cơ.
+ Khi gặp bài toán có sử dụng HNO3, H2SO4 đặc nóng.
Lưu ý:
+ Xác định chính xác chất khử, chất oxi hóa (dựa vào sự thay đổi số oxi hóa của các nguyên tử trong các chất).
+ Có thể áp dụng định luật bảo toàn e cho một số phương trình, nhiều phương trình hoặc toàn bộ quá trình.
+ Xác định các chất nhường và nhận e. Nếu xét cho một quá trình, chỉ cần xác định trạng thái đầu và trạng thái cuối số oxi hóa của nguyên tố, thường không quan tâm đến trạng thái trung gian số oxi hóa của nguyên tố.
+ Khi áp dụng phương pháp bảo toàn e thường sử dụng kèm các phương pháp bảo toàn khác như bảo toàn khối lượng, bảo toàn nguyên tố.
Ví dụ minh họa
Ví dụ 1: Đốt 17,88g hỗn hợp X gồm Al và Fe trong khí Cl2 thu được hỗn hợp chất rắn Y. Cho Y vào nước dư, thu được dung dịch Z và 2,4 gam kim loại. Dung dịch Z tác dụng tối đa với 0,228 mol KMnO4 trong dung dịch H2SO4 (không tạo SO2). Phần trăm khối lượng Fe trong hỗn hợp là:
A. 72,91%.
B. 64%
C. 66,67%
D. 69,8%
Lời giải:
Đặt x, y lần lượt là số mol của Fe và Al, ta có:
⇒ 56a + 27b = 17,88
Vì trước và sau chuỗi các phản ứng đều là khí Cl2
⇒ Ta quy đổi hỗn hợp muối thành Fe, Al và Cl2
Theo định luật bảo toàn e ta có:
ne cho = ne nhận
⇒ 3nFe phản ứng + 3nAl = 5nKMnO4
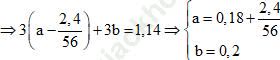
⇒ Đáp án đúng là D
Ví dụ 2: Hòa tan 15 gam hỗn hợp X gồm hai kim loại Mg và Al vào dung dịch Y gồm HNO3 và H2SO4 đặc thu được 0,1 mol mỗi khí SO2, NO, NO2, N2O. Phần trăm khối lượng của Al và Mg trong X lần lượt là:
A. 63% và 37%.
B. 36% và 64%
C. 50% và 50%.
D. 46% và 54%.
Lời giải:
Đặt: ![]()
Ta có: 24x + 27y = 15 (1)
Các quá trình nhường electron:

Các quá trình nhận electron:

⇒Ví dụ 3: Đốt cháy 5,6g Fe bằng oxi không khí, sau phản ứng thu được 6,8g hỗn hợp các chất rắn. Hòa tan hoàn toàn hỗn hợp chất rắn bằng dung dịch HNO3 dư. Sản phẩm là Fe (NO3)3, V lít khí NO ở đktc và nước. Tính V?
A. 2,24 lít.
B. 1,12 lít.
C. 3,36 lít.
D. 5,6 lít.
Lời giải:
Nhận thấy sau khi qua HNO3 thì tất cả Fe đều chuyển về Fe3+. Như vậy trạng thái đầu là Fe, trạng thái cuối là Fe3+

⇒ Đáp án đúng là B
Ví dụ 4: Cho 33,35 gam hỗn hợp A gồm Fe3O4, Fe (NO3)3,Cu tác dụng hoàn toàn với dung dịch chứa 0.414 mol H2SO4 (loãng) thì thu được khí NO duy nhất và dung dịch B chỉ chứa 2 muối. Cô cạn B thu được bao nhiêu gam muối khan?
A. 64,400 hoặc 61,520.
B. 65,976 hoặc 61,520.
C. 73,122 hoặc 64,400.
D. 65,976 hoặc 75,922.
Lời giải:
Gọi x, y, z là số mol của Fe3O4,Fe (NO3)3, Cu có trong hỗn hợp A.
232x + 242y + 64z = 33,35 (l).
A + dd H2S04 → dd B chứa 2 muối ⇒ có 2 trường hợp xảy ra.
+Trường hợp 1: B chứa FeSO4 và CuSO4.
Các quá trình nhường và nhận electron:
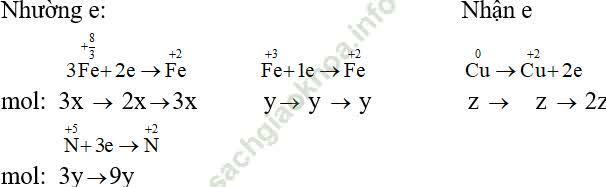
Áp dụng định luật bảo toàn electron ta có: 2x + y + 9y = 2z ⇒ x + 5y - z = 0 (2)
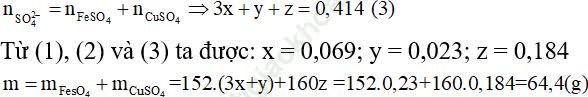
+Trường hợp 2: B chứa Fe2(S04)3 và CuSO4.
Các quá trình nhường và nhận electron:
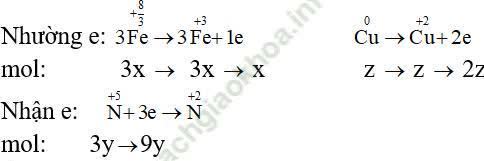
Áp dụng định luật bảo toàn e, ta có:
x + 2z = 9y
⇒ x - 9y + 2z = 0 (4)
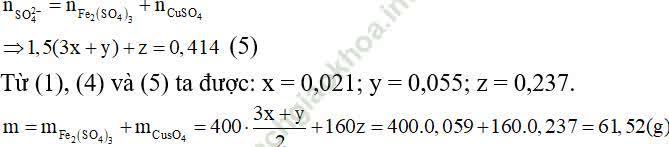
⇒ Đáp án đúng là A.
Ví dụ 5: Cho 3,024 gam một kim loại M tan hết trong dung dịch HNO3 loãng, thu được 940,8 ml khí NxOy (sản phẩm khử duy nhất ở đktc) có tỉ khối đối với H2 bằng 22. Khí NxOy và kim loại M là:
A. NO và Mg
B. N2O và Al
C. N2O và Fe
D. NO2 và Al
Lời giải:
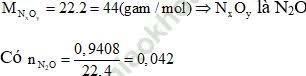
Gọi n là hóa trị của kim loại M. Các quá trình nhuờng và nhận electron như sau:
+) Quá trình nhường electron: ![]()
+) Quá trình nhận electron: ![]()
Áp dụng định luật bảo toàn mol e, ta có: n. nM = 8nN2O
⇒ Đáp án đúng là B.
Ví dụ 6: Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối MgSO4, H2O và sản phẩm khử X. X là:
A. SO2.
B. S.
C. H2S.
D. SO2, H2S.
Lời giải:
Dung dịch H2SO4 đậm đặc vừa là chất oxi hóa vừa là môi trường.
Gọi a là số oxi hóa của S trong X.
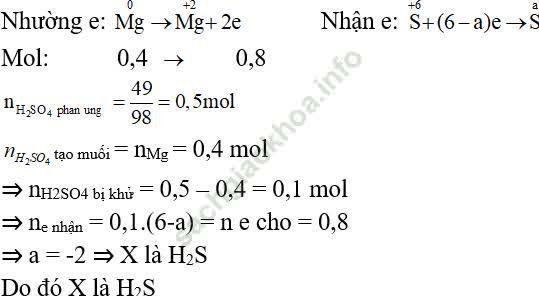
⇒ Đáp án đúng là C.
Ví dụ 7: Hoà tan hoàn toàn 1,2 gam kim loại M vào dung dịch HNO3 dư thu được 0,224 lít khí N2 (sản phẩm khử duy nhất) ở (đktc). Kim loại M là:
A. Mg.
B. Fe.
C. Al.
D. Cu.
Lời giải:
Các quá trình nhường và nhận electron:
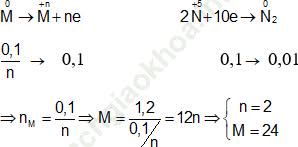
⇒ Đáp án đúng là A: M là Mg
Ví dụ 8: Trộn 0,81 gam bột nhôm với bột Fe2O3 và CuO rồi đốt nóng để tiến hành phản ứng nhiệt nhôm thu được hỗn hợp
A. Hoà tan hoàn toàn A trong dung dịch HNO3 đun nóng thu được V lít khí NO (sản phẩm khử duy nhất) ở đktc. Giá trị của V là:
A. 0,224 lít.
B. 0,672 lít.
C. 2,24 lít.
D. 6,72 lít.
Lời giải:
Tóm tắt theo sơ đồ:
Như vậy, thực chất trong bài toán này toàn bộ quá trình chỉ có quá trình cho và nhận electron của nguyên tử Al và N.
Các quá trình nhường và nhận electron như sau:
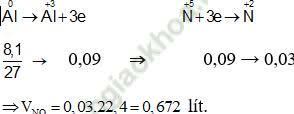
⇒ Đáp án đúng là B.
Ví dụ 9: Điện phân dung dịch chứa m gam hỗn họp 2 muối CuSO4 và NaCl bằng điện cực trơ, có màng ngăn đến khi nước bị điện phân ở cả 2 điện cực thì ngừng điện phân. Dung dịch sau điện phân hoà tan vừa đủ 1,16 gam Fe3O4 và ở anot của bình điện phân có 448ml khí bay ra (đktc). Khối lượng dung dịch giảm sau khi điện phân là:
A. 7,10.
B. 1,03.
C. 8,60.
D. 2,95.
Lời giải:
Vì dung dịch sau điện phân hòa tan được Fe3O4 nên dung dịch sau điện phân có chứa H+.
Thứ tự các phản ứng xảy ra như sau:
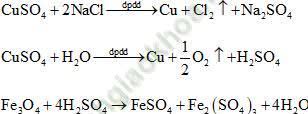
Ta có các bán phản ứng như sau:

⇒ Đáp án đúng là D
Ví dụ 10: Cho 39,2 gam hỗn hợp M gồm Fe, FeO, Fe3O4, Fe2O3, CuO và Cu tác dụng vừa đủ với HNO3 nồng độ a (mol/lít), thu được 0,2 mol NO (sản phẩm khử duy nhất). Giá trị của a là
A. 2,0
B. 1,5
C. 3,0
D. 1,0
Lời giải:
Coi hỗn hợp gồm Fe (x mol); Cu (y mol) và 0,45 mol O
⇒ 56x + 64y + 7,2 = 39,2 (l)
Áp dụng định luật bảo toàn e ta có:
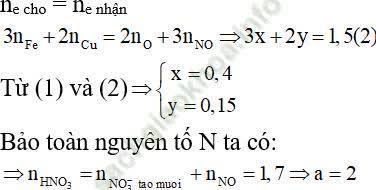
⇒ Đáp án đúng là A.
Bài tập tự luyện
Bài 1: Đốt cháy hỗn hợp gồm l, 92g Mg và 4,48g Fe với hỗn hợp khí X gồm O2 và Cl2. Sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan Y bằng 120ml dung dịch HCl 2M (vừa đủ) thu được dung dịch Z. Cho AgNO3 (dư) vào Z thu được 56,69g kết tủa. Phần trăm thể tích khí Cl2 trong hỗn hợp X là.
A. 51,72%
B. 76,70%
C. 53,85%
D. 56,36%

⇒ Đáp án C
Bài 2: Cho 61,2g hỗn hợp X gồm Cu và Fe3O4 tác dụng với dung dịch HNO3 loãng, đun nóng và khuấy đều. Sau khi các phản ứng xảy ra hoàn toàn thu được 3,361 NO (sản phẩm khử duy nhất, đktc), dung dịch Y và còn lại 2,4g kim loại. Cô cạn dung dịch Y thu được m g muối khan. Giá trị của m là:
A. 151,5
B. 97,5
C. 108,9
D. 137,1
nNO = 0,15 (mol), kim loại còn lại sau phản ứng là Cu.
nCu dư = 0,0375 (mol)
nX phản ứng = 61,2 - 2,4 = 58,8 (g)
Đặt x và y lần lượt là số mol Cu và Fe3O4.
Quy Fe3O4 thành hỗn hợp FeO và Fe2O3 có tỉ lệ mol 1: 1
Theo khối lượng X ⇒ 64x + 232y = 58,8
Bảo toàn electron ta có: ne cho = ne nhận
⇒ Đáp án D
Bài 3: Nhiệt phân 50,56g KMnO4 sau một thời gian thu được 46,72 gam chất rắn. Cho toàn bộ lượng khí sinh ra phản ứng hết với hỗn hợp X gồm Mg, Fe thu được hỗn hợp Y nặng 13,04gam. Hòa tan hoàn toàn hỗn hợp Y trong dung dịch H2SO4 đặc nóng dư thu được 1,344 lít SO2 (đktc).Hỏi % khối lượng Mg trong X là:
A. 52,17%
B. 46,15%
C. 28,15%
D. 39,13%

⇒ Đáp án D
Bài 4: Hỗn hợp X gồm 0,15 mol Mg và 0,1 mol Fe cho vào 500ml dung dịch Y gồm AgNO3 và Cu (NO3)2; sau khi phản ứng xong nhận được 20g chất rắn Z và dung dịch E; cho NaOH dư vào dung dịch E, lọc kết tủa, nung ngoài không khí nhận được 8,4g hỗn hợp 2 oxit. Nồng độ mol của AgNO3 và Cu (NO3)2 lần lượt là:
A. 0,24M và 0,5M
B. 0,12M và 0,36M
C. 0,12M và 0,3M
D. 0,24M và 0,6M
AgNO3 và Cu (NO3)2 phản ứng hết
⇒ Fe còn dư hoặc phản ứng vừa đủ.

Đặt x và y lần lượt là số mol của Ag và Cu
⇒ 108x + 64y = 16,08
Bảo toàn electron ta có: ne cho = ne nhận
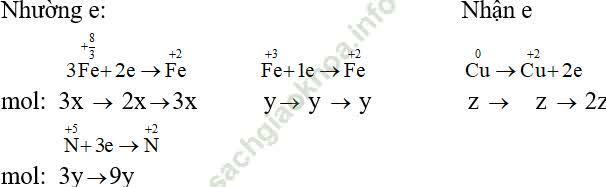
⇒ Đáp án C
Bài 5: Dẫn luồng khí CO đi qua hỗn hợp gồm CuO, Fe2O3, Al2O3và ZnO đun nóng, sau một thời gian thu được chất rắn X và hỗn hợp khí Y. Cho Y lội chậm qua bình đựng dung dịch Ba (OH)2 dư, kết thúc phản ứng thu được 49,25g kết tủa. Cho toàn bộ X phản ứng vói lượng dư dung dịch H2SO4 đặc nóng, kết thúc phản ứng thu được V lít SO2 (sản phẩm khử duy nhất, đktc). Giá trị của V là:
A. 4,48 lít
B. 3,36 lít
C. 6,72 lít
D. 5,6 lít
Bảo toàn electron cho quá trình khử Oxit của CO ta có (l)
ne cho = ne nhận ne nhận
Bảo toàn e cho quá trình Oxi hóa bởi H2SO4 (2)
⇒ ne cho = ne nhận ne cho
Vì các Oxit trước quá trình 1 và sau quá trình 2 ở trạng thái có số oxi hóa cao nhất
⇒ ne nhận = ne cho
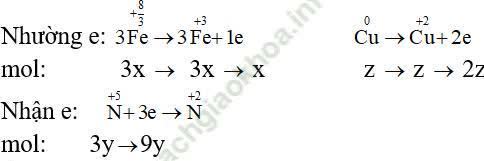
⇒ Đáp án D
Bài 6: Hòa tan hoàn toàn 30,4 g chất rắn X gồm Cu, CuS, Cu2S. và S bằng HNO3 dư, thoát ra 20,16 lít khí NO duy nhất (đktc) và dung dịch Y. Thêm Ba (OH)2 dư vào Y thu m gam kết tủa. Giá trị của m là:
A. 119,5 g
B. 112 g
C. 115,9 g
D. 110,95 g
Coi hỗn hợp chỉ gồm Cu (a mol) và S (b mol)
⇒ 64a + 32b = 30,4
Bảo toàn electron ta có: 2nCu + 6nS = 3nNO
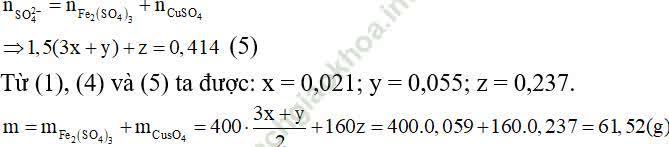
⇒ Đáp án D
Bài 7: Điện phân dung dịch X chứa a mol CuSO4 và 0,2 mol KCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giây, thu được 2,464 lít khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thu được ở cả hai điện cực là 5,824 lít (đktc). Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của a là
A. 0,15
B. 0,18.
C. 0,24
D. 0,26
Sau t giây: nkhí anot = 0,11 mol
nCl2 = ½ nCl- = 0,1 mol < 0,11 mol ⇒ Cl- điện phân hết và H2O điện phân sinh ra O2 ở anot;
nO2 = 0,11 – 0,1= 0,01
Ở anot:
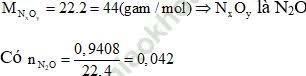
⇒ Đáp án A
Bài 8: Cho 61,2g hỗn hợp X gồm Cu và Fe3O4 tác dụng với dung dịch HNO3 loãng, đun nóng, khuấy đều. Sau khi các phản ứng xảy ra hoàn toàn thu được 3,361 NO (sản phẩm khử duy nhất, ở đktc), dung dịch Y và 2,4g kim loại. Cô cạn Y thu được m gam muối khan. Giá trị của m là
A. 137,1
B. 151,5
C. 97,5
D. 108,9
Quy đổi X thành hỗn hợp các đơn chất với: Cu (x mol); Fe (1,5y mol); O2 (y mol)
⇒ 64x + 116y = 61,2 - 2,4 = 58,8 (l)
Bảo toàn electron ta có: ne cho = ne nhận
⇒ Đáp án B
Bài 9: Cho m gam hỗn hợp X gồm Fe2O3; CuO; MgO; FeO; Fe3O4 vào dung dịch H2SO4 đặc nóng thu được 3,36 lít khí SO2 (đktc). Mặt khác nung nóng 2m gam hỗn hợp X với khí CO dư thu được chất rắn Y và hỗn hợp khí Z. Cho Z vào dung dịch Ca (OH)2dư thu được 70 g kết tủa. Cho chất rắn Y vào dung dịch HNO3 đặc nóng, dư thu được V khí NO2 (là sản phẩm khử duy nhất ở đktc). Giá trị của V là:
A. 44,8 lít
B. 22,4 lít
C. 17,92 lít
D. 89,6 lít
Với m gam X + H2SO4 (đặc nóng):
Bảo toàn e ta có ne cho = ne nhận = = 0,3 (mol) = ne X→ B
Với 2m gam X phản ứng với CO:
⇒ Bảo toàn electron ta có:
ne cho = ne nhận = = 0,14 (mol)
⇒ Với m gam X phản ứng với CO có:
⇒ V = 2.22.4 = 44,8 lít ⇒ Đáp án A
Bài 10: Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4 và Cu vào dung dịch HCl dư thấy có 1 mol axit phản ứng và còn lại 0,256a gam chất rắn không tan. Mặt khác khử hoàn toàn a gam hỗn hợp A bằng H2 thu được 42g chất rắn. Tính phần trăm khối lượng Cu trong hỗn hợp A.
A. 44,8%
B. 50%
C. 32%
D. 25,6%
Còn lại 1 phần chất rắn không tan ⇒ Cu dư
![]()
Bảo toàn điện tích ta có: nHCl = 2nO trong A = 6x + 8y (1)
Bảo toàn khối lượng ta có: 160x + 232y + 64z = 50 – 0,256.50 = 37,2g (2)
Cu + 2Fe3+ → Cu2+ +2 Fe2+
Cu + 3Fe+8/3 → Cu2+ + 3Fe2+
Bảo toàn e ta có: x + y = z (3)
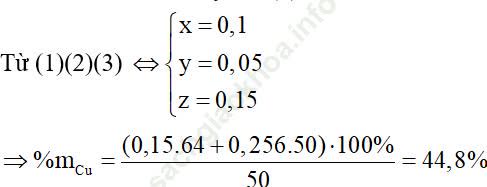
⇒ Đáp án A