Phương pháp chọn đại lượng thích hợp trong hóa học cực hay, có lời giải - Chuyên đề Hóa 12
Phương pháp giải
1. Nội dung
Có một số bài toán tưởng như thiếu dữ kiện gây khó khăn cho việc tính toán, vì vậy ta phải tự chọn một đại lượng phù hợp để phục vụ cho việc giải toán.
2. Phạm vi sử dụng
Khi chúng ta gặp bài toán có dạng: Đề bài cho dưới dạng tổng quát (không có giá trị xác định) hoặc cho tỉ lệ thể tích tỉ lệ số mol các chất:
+ Chọn mol nguyên tử hoặc phân tử chất tham gia
+ Chọn một mol hỗn hợp các chất tham gia phản ứng
+ Chọn đúng tỉ lệ lượng chất trong đầu bài đã cho
+ Chọn cho thông số một giá trị phù hợp để đơn giản phép tính
Ví dụ minh họa
Ví dụ 1: Hòa tan hết hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20% thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,757%. Nồng độ của MgCl2 trong dung dịch Y là:
A. 11,787%
B. 84,243%
C. 88,213%
D. 15,757%
Bài giải:
Để đơn giản cho quá trình tính toán, ta sẽ chọn số mol Fe trong hỗn hợp ban đầu là 1 và đi tìm số mol của Mg tương ứng khi đó dựa vào các điều kiện giả thiết.
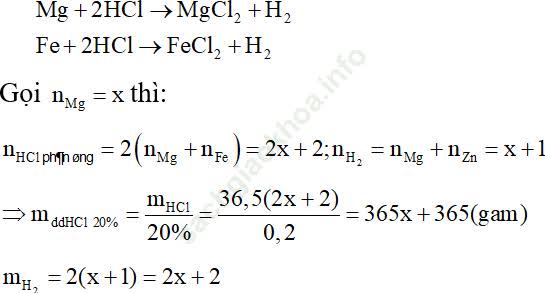
Do đó, theo định luật bảo toàn khối lượng ta có:

Ví dụ 2: Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là?
A. 50%.
B. 40%.
C. 25%.
D. 36%.
Bài giải:
Sử dụng sơ đồ đường chéo ⇒ nN2: nH2 = 1: 4
Chọn nN2 = 1 mol; nH2 = 4 mol

Hiệu suất tính theo N2; nsau pư = nH2 + nN2 + nNH3 = 5 – 2x (mol)
Áp dụng định luật bảo toàn khối lượng:
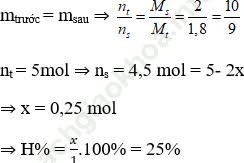
⇒ Đáp án đúng là C
Ví dụ 3: Một hỗn hợp X gồm CO2 và một oxit của nitơ có tỉ khối đối với H2 là 18,5. Công thức oxit của nitơ và % thể tích CO2 trong hỗn hợp X là:
A. NO; 40%
B. NO; 50%
C. N2O; 40%
D. N2O; 50%
Bài giải:
MX = 18,5.2 = 37
⇒ MNxOy < 37.
⇒ 14x + 16y < 37. x, y phải nguyên dương ⇒ x = 1, y = 1.
Vậy oxit của nitơ là NO.
Giả sử trong 1mol hỗn hợp X có a (mol) CO2 và (1-a)mol NO.
Ta có: mX = M. n = 37g 44a + 30 (1 – a) = 37 ⇒ a = 0,5
⇒ %VCO2 = %VNO = 50%
⇒ Đáp án đúng là B
Ví dụ 4: Cho hỗn hợp X gồm 1 anken và H2 tỉ khối hơi so với He =3,33. Cho X qua Ni nung nóng, đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp khí Y có tỉ khối hơi so với He = 4. Tìm công thức phân tử của anken.
A. C2H4
B. C3H6
C. C4H8
D. C5H10
Bài giải:
Ta có: MX = 3,33.4 = 13,32; MY = 4.4 = 16
MY = 16 ⇒ trong hỗn hợp Y có H2, anken phản ứng hết H2 dư
Áp dụng định luật bảo toàn khối lượng ta có:
mX = mY
Giả sử: nX = 400 mol; nY = 333 mol
nanken pư = nX - nY = 400 - 333 = 67 (mol)
nH2(X) = 400 – 67 = 333 mol
Ta có sơ đồ đường chéo như sau:
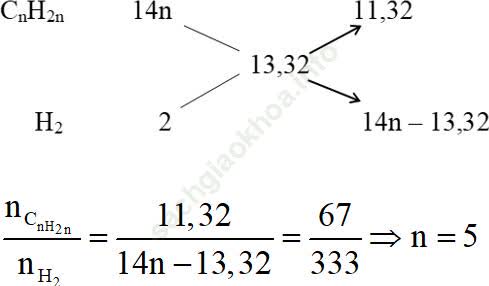
Công thức phân tử anken là: C5H10
⇒ Đáp án đúng là D
Ví dụ 5: Cho dung dịch axit axetic có nồng độ x% tác dụng vừa đủ với dung dịch NaOH 10% thì thu được dung dịch muối có nồng độ 10,25%. Gía trị của x là?
A. 20
B. 16
C. 15
D. 13
Bài giải:
Chọn 1 mol CH3COOH

⇒ x = 15%
⇒ Đáp án đúng là C
Bài tập tự luyện
Bài 1: Hoà tan a gam một oxit kim loại hoá trị II (không đổi) bằng một lượng vừa đủ dung dịch H2SO4 4,9% người ta thu được một dung dịch muối có nồng độ 5,88%. Tên kim loại hoá trị II là?
A. Fe
B. Ca
C. Mg
D. Ba
Cách giải:
Giả sử có 1 mol MO phản ứng m = (M + 16)gam
Phương trình phản ứng
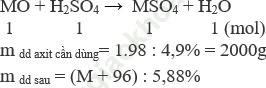
Áp dụng định luật bảo toàn khối lượng ta có:
mMO + mddH2SO4 = mdd sau
⇒ M + 16 + 2000 = (M + 96): 5,88%
⇒ M = 24 (M là Mg)
⇒ Đáp án đúng là C
Bài 2: Hỗn hợp khí gồm oxi và ozon có tỉ khối so với hiđro là 18. Phần trăm theo thể tích của từng khí trong hỗn hợp đầu lần lượt là?
A. O2: 75%; O3: 25%
B. O2: 40%; O3: 60%
C. O2: 25%; O3: 75%
D. O2: 60%; O3: 40%
Cách giải:
Giả sử có 1 mol hỗn hợp khí
Gọi số mol của oxi là x ⇒ Số mol của ozon là 1-x
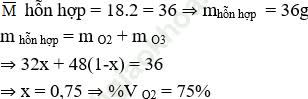
⇒ % VO3 = 25%
⇒ Đáp án đúng là A
Bài 3: Oxi hóa hoàn toàn m gam kim loại X thì thu 1,25m gam oxit. Hòa tan muối cacbonat của kim loại Y bằng một lượng vừa đủ dung dịch H2SO4 9,8% thì thu được dung dịch muối sunfat có nồng độ 14,18%. Hai kim loại X, Y lần lượt là?
A. Cu và Fe.
B. Al và Fe.
C. Cu và Zn.
D. Zn và Mg.
Cách giải:
Giả sử m = 16 gam = mkim loại ⇒ moxit = 20 gam
⇒ mO = 4 gam ⇒ nO = 0,25 mol⇒ ne nhận= 0,5 mol.
Gọi số e mà kim loại nhường là n, ta có: M = 32n. Chọn được n = 2 (Cu)
Giả sử dung dịch H2SO4 có khối lượng 100 gam ⇒ nH2SO4 = 0,1 mol.
Muối cacbonat dạng M2(CO3)n.

⇒ M = 28n. Chọn được n = 2 ⇒ M = 56 (Fe).
⇒ Đáp án đúng là A.
Bài 4: Oxi hóa C2H5OH bằng CuO nung nóng, thu được hỗn hợp chất gồm CH3CHO, C2H5OH dư và H2O có = 40g. Hiệu suất phản ứng oxi hóa là?%
A. 25%
B. 35%
C. 45%
D. 55%
Cách giải:
Chọn 1 mol H2SO4. Đặt a mol C2H5OH bị oxi ⇒ a là hiệu suất của phản ứng oxi hóa ancol

⇒ Đáp án đúng là A.
Bài 5: Hỗn hợp A gồm anken và hđro có tỉ khối so với H2 bằng 6,4. Cho A đi qua niken nung nóng được hỗn hợp B có tỉ khối so với H2 bằng 8 (giả sử hiệu suất phản ứng xảy ra là 100%). Công thức phân tử của anken là?
A. C2H4
B. C3H6
C. C4H8
D. C5H10
Cách giải:
Xét 1 mol hỗn hợp A gồm a mol CnH2n và 1-a mol H2
MA = 6,4.2 = 12,8
⇒ m A = 14. na + 2 (1 –a) = 12,8 (1)

Áp dụng định luật bảo toàn khối lượng ta có: mA = mB
⇒ a = 0,2 mol thay vào (1) ⇒ n = 4
⇒ Anken là: C4H8
⇒ Đáp án đúng là C
Bài 6: Hòa tan hoàn toàn một lượng kim loại R hóa trị n bằng dung dịch H2SO4 loãng rồi cô cạn dung dịch sau phản ứng thu được một lượng muối khan có khối lượng gấp 5 lần khối lượng kim loại R ban đầu đem hòa tan. Kim loại R là?
A. Al
B. Ba
C. Zn
D. Mg
Cách giải:
Xét 1 mol kim loại ứng với R gam tham gia phản ứng
Ta có: 5R = 0,5. (2R + 96n)
⇒ R = 12n ⇒ R = 24 (Mg)
⇒ Đáp án đúng là D
Bài 7: Hỗn hợp gồm hiđrocacbon X và oxi có tỉ lệ số mol tương ứng là 1: 10. Đốt cháy hoàn toàn hỗn hợp trên thu được hỗn hợp khí Y. Cho Y qua dung dịch H2SO4 đặc, thu được hỗn hợp khí Z có tỉ khối đối với H2 = 19. Công thức phân tử của X là?
A. C3H8
B. C3H6
C. C4H8
D. C3H4
Cách giải:
Chọn nCxHy = 1 mol; nO2 = 10 mol
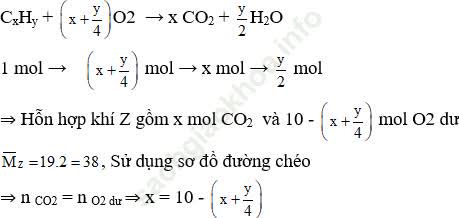
⇒ 8x = 40 – y
⇒ x = 4; y = 8
⇒ Đáp án đúng là C
Bài 8: Hỗn hợp X gồm N2 và H2 có MX trung binh = 12,4. Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết rằng hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. có trị số là?
A. 15,12
B. 18,23
C. 14,76
D. 13,48
Cách giải:
Xét 1 mol hỗn hợp X ⇒ m X = 12,4g gồm a mol N2 và (1-a) mol H2
Ta có: 28a + 2. (1-a) = 12,4
⇒ a = 0,4 mol ⇒ nH2 = 0,6 mol

nY = 0,32 + 0,36 + 0,16 = 0,84 mol
Theo định luật bảo toàn khối lượng: mX = mY
Bài 9: A là hỗn hợp gồm một số hiđrocacbon ở thể khí, B là không khí. Trộn A với B ở cùng nhiệt độ áp suất theo tỉ lệ thể tích (1: 15) được hỗn hợp khí D. Cho D vào bình kín dung tích không đổi V. Nhiệt độ và áp suất trong bình là t°C và p atm. Sau khi đốt cháy A, trong bình chỉ có N2, CO2 và hơi nước với VH2O: VCO2 = 7: 4. Để đưa về bình t°C, áp suất trong bình sau khi đốt là p1 có giá trị là?
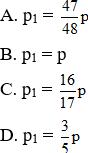
Cách giải:
Đốt A:
Vì phản ứng chỉ có N2, H2O, CO2 ⇒ Các hiđrocacbon bị đốt cháy hết và O2 vừa đủ
Chọn CxHy = 1 ⇒ nB = 15 mol

⇒ Đáp án đúng là A
Bài 10: Đốt cháy hoàn toàn a gam hỗn hợp X gồm hai hiđrocacbon A, b thu được![]() . Nếu thêm vào hỗn hợp X một nửa lượng A có trong hỗn hợp X rồi đốt cháy hoàn toàn thì thu được
. Nếu thêm vào hỗn hợp X một nửa lượng A có trong hỗn hợp X rồi đốt cháy hoàn toàn thì thu được ![]() . Biết A, B không làm mất màu dung dịch brom. Công thức phân tử của A là?
. Biết A, B không làm mất màu dung dịch brom. Công thức phân tử của A là?
A. C2H2
B. C2H6
C. C6H12
D. C6H14
Cách giải:
Chọn a = 41g
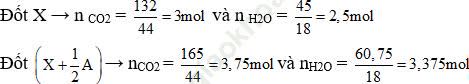
Đốt 1/2A thu được (3,75 – 3) = 0,75 mol CO2 và (3,375 – 2,5) = 0,875 mol H2O
Đốt cháy A thu được nCO2 = 1,5 và nH2O = 1,75 mol
Vì nH2O > nCO2 ⇒ A là ankan: CnH2n+2
Ta có:
⇒ A là C6H14
⇒ Đáp án đúng là D