Bài 8 : Amoniac và muối amoni - Giải BT Hóa học 11
Bài 8: Amoniac và muối amoni
Bài 1 (trang 37 SGK Hóa 11): Mô tả và giải thích hiện tượng xảy ra trong thí nghiệm chứng minh rằng amoniac tan nhiều trong nước?
Bài giải:+) Thí ngiệm:
- Khí amoniac được nạp vào đầy bình thuỷ tinh, đậy bình bằng nút cao su có ống thuỷ tinh nhọn xuyên qua.
- Nhúng đầu ống thuỷ tinh vào chậu nước có pha vài giọt phenolphtalein.
+) Hiện tượng: Nước dâng lên rất nhanh trong ống thuỷ tinh nhọn sau đó phun lên có tia màu hồng
+) Giải thích: Khí amoniac tan rất nhanh trong nước là giảm áp suất trong bình nên áp suất ngoài không khí nén vào mặt thoáng của chậu nước làm nước phun lên trong ống thuỷ tinh thành dòng.
Amoniac tan trong nước tạo thành dung dịch có tính bazơ làm cho phenolphtalein không màu chuyển thành màu hồng.
Bài 2 (trang 37 SGK Hóa 11): Hoàn thành sơ đồ chuyển hóa sau và viết các phương trình hóa học:
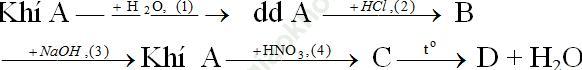
Biết rằng A là hợp chất của nitơ.
Bài giải:- Sơ đồ:
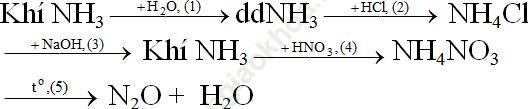
Phương trình phản ứng:
(1) Khí NH3 + H2O ⇆ NH4OH
(2) NH3 + HCl → NH4Cl
(3) NH4Cl + NaOH → NH3↑ + NaCl + H2O
(4) NH3 + HNO3 → NH4NO3
(5) NH4NO3 → N2O + 2H2O
Bài 3 (trang 37 SGK Hóa 11): Hiện nay, để sản xuất amoniac, người ta điều chế nitơ và hiđro bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí metan (thành phần chính của khí thiên nhiên). Phản ứng giữa khí metan và hơi nước tạo ra hiđro và cacbon đioxit. Để loại khí oxi và thu khí nitơ, người ta đốt khí metan trong một thiết bị kín chứa không khí. Hãy viết phương trình hoá học của phản ứng điều chế khí hiđro, loại khí oxi và tổng hợp khí amoniac?
Bài giải:Phương trình điều chế hiđro:
CH4 + 2H2O -to, xt→ CO2 + 4H2
Phương trình loại khí oxi:
CH4 + 2O2 -to→ CO2 + 2H2O
Phương trình tống hợp amoniac:
N2 + 3H2 -450-500o, Fe, 200-300atm→ 2NH3
Bài 4 (trang 38 SGK Hóa 11): Trình bày phương pháp hoá học để phân biệt các dung dịch: NH3, Na2SO4, NH4Cl, (NH4)2SO4. Viết phương trình hoá học của các phản ứng đã dùng.
Bài giải:Phân biệt các dung dịch NH3, Na2SO4, NH4Cl, (NH4)2SO4 như sau:
- Cho quỳ tím vào từng ống:
+ Ống màu xanh là dung dịch NH3;
+ Hai ống có màu hồng là NH4Cl và (NH4)2SO4;
+ Ống không có hiện tượng gì là Na2SO4.
- Cho Ba (OH)2 vào hai ống làm hồng quỳ tím.
+ Nếu thấy ống nào có khí bay ra mùi khai là NH4Cl,
+ Ống vừa có khí bay ra mùi khai vừa có kết tủa là (NH4)2SO4.
Phương trình phản ứng hóa học như sau:
(NH4)2SO4 + Ba (OH)2 → BaSO4 ↓ + 2NH3 ↑ + 2H2O
2NH4Cl + Ba (OH)2 → BaCl2 + 2NH3 + 2H2O
Bài 5 (trang 38 SGK Hóa 11): Muốn cho cân bằng của phản ứng tổng hợp amoniac sang phải, cần phải đồng thời:
A. Tăng áp suất và tăng nhiệt độ.
B. Giảm áp suất và giảm nhiệt độ.
C. Tăng áp suất và giảm nhiệt độ.
D. Giảm áp suất và tăng nhiệt độ.
Bài giải:- Đáp án đúng là: C.
- Phản ứng điều chế NH3:
- Sau phản ứng số mol khí giảm nên theo nguyên lí chuyển dịch cân bằng khi tăng áp suất cân bằng chuyển dịch theo chiều giảm áp suất (chiều thuận).
- Phản ứng này toả nhiệt nên khi giảm nhiệt độ cân bằng chuyển dịch theo chiều tăng nhiệt độ (chiều thuận)
Bài 6 (trang 38 SGK Hóa 11): Trong phản ứng nhiệt phân các muối NH4NO2 và NH4NO3 số oxi hoá của nitơ biến đổi như thế nào? Nguyên tử nitơ trong ion nào của muối đóng vai trò chất khử và nguyên tử nitơ trong ion nào của muối đóng vai trò chất oxi hoá?
Bài giải:Phản ứng nhiệt phân:
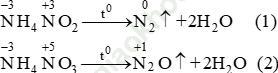
Trong hai phản ứng trên số oxi hoá của nitơ trong mỗi phản ứng đều thay đổi. Trong mỗi phân tử muối một nguyên tử nitơ có số oxi hoá tăng, một nguyên tử có số oxi hoá giảm, đây là phản ứng oxi hoá khử nội phân tử. Ở cả hai phản ứng nitơ nguyên tử trong ion NH+4 đều là chất khử (chất cho e) nitơ từ số oxi hoá -3 tăng lên 0 ở phản ứng (1) và lên +1 ở phản ứng (2).Nguyên tử nitơ trong ion NO2- và NO3- là chất oxi hoá (chất nhận e). Ở phản ứng (1) số oxi hoá của N từ +3 (trong NO2-) xuống 0 và ở phản ứng (2) số oxi hoá của nitơ từ +5 (trong NO3-) xuống +1.
Bài 7 (trang 38 SGK Hóa 11): Cho dung dịch NaOH dư vào 150,0 ml dung dịch (NH4)2SO4 1,00M, đun nóng nhẹ.
a. Viết phương trình hoá học ở dạng phân tử và dạng ion rút gọn?
b. Tính thể tích khí (đktc) thu được?
Bài giải:a) Phương trình hóa học dạng phân tử:
2NaOH + (NH4)2SO4 → 2NH3↑ + Na2SO4 + 2H2O
Phương trình hóa học dạng ion:
NH4+ + OH- → 2NH3↑ + H2O
b) n(NH4)2SO4 = 0,15.1 = 0,15 mol
Theo phương trình: nNH3 = 2. n (NH4)2SO4 = 0,15.2 = 0,3 mol
VNH3 = 0,3.22,4 = 6,72 lít
Bài 8 (trang 38 SGK Hóa 11): Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hiđro để điều chế 17,00 gram NH3. Biết rằng hiệu suất chuyển hoá thành amoniac là 25%. Các thể tích khí được đo ở đktc.
A. 44,8 lit N2 và 134,4 lit H2
B. 22,4 lit N2 và 134,4 lit H2
C. 22,4 lit N2 và 67,2 lit H2
D. 44,8 lit N2 và 67,2 lit H2
Bài giải:- Đáp án đúng là: A
Cách tính:

Do hiệu suất 25% nên
nN2cần dùng = 2 (mol) và nH2cần dùng = 6 (mol).
⇒ VN2 = 2.22,4 = 44,8 (lit) và VH2 = 22,4.6= 134,4 (lit).
Bài trước: Bài 7 : Nitơ - Giải BT Hóa học 11 Bài tiếp: Bài 9: Axit nitric và muối nitrat - Giải BT Hóa học 11