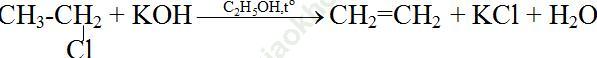Bài 39 : Dẫn xuất halogen của hiđrocacbon - Giải BT Hóa học 11
Bài 39: Dẫn xuất halogen của hiđrocacbon
Bài 1 (trang 177 SGK Hóa 11): Gọi tên mỗi chất sau: CH3-CH2Cl, CH2=CH-CH2Cl, CHCl3. C6H5Cl. Viết phương trình hoá học của các phản ứng điều chế mỗi chất trên từ hiđrocacbon tương ứng.
Bài giải:| CH3-CH2Cl | Etyl clorua |
| CH2=CH-CH2Cl | 3-clopropen, anlyl clorua |
| CHCl3 | Triclometan, clorofom |
| C6H5Cl | Clobenzen, phenyl clorua |
Điều chế:
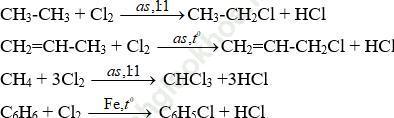
Bài 2 (trang 177 SGK Hóa 11): Viết phương trình hoá học của phản ứng thuỷ phân các chất sau trong dung dịch NaOH: 1,2- đicloetan; benzylclorua; antyl bromua; xiclohexyl clorua.
Bài giải:Phương trình phản ứng theo thứ tự các chất:
Cl-CH2-CH2-Cl + 2NaOH → OH-CH2-CH2-OH + 2NaCl
C6H5-CH2-Cl + NaOH → C6H5-CH2-OH + NaCl
CH2=CH-CH2-Br + NaOH → CH2=CH-CH2-OH + NaBr
C6H11-Cl + NaOH → C6H11-OH + NaCl
Phương trình phản ứng theo CTCT:
Bài 3 (trang 177 SGK Hóa 11): Cho nhiệt độ sôi (oC) của một số dẫn xuất halogen trong bảng dưới đây:
| X | Cl | Br | I |
| CH3-X | -24 | 5 | 42 |
| C2H5-X | 1 | 38 | 72 |
| n-C3H7-X | 47 | 71 | 102 |
| n-C4H9-X | 78 | 102 | 131 |
Nhận xét về sự biến đổi nhiệt độ sôi theo chiều tăng mạch cacbon (theo hàng dọc) và theo nguyên tử khối của halogen (hàng ngang). Giải thích sơ bộ.
Bài giải:– Theo chiều tăng mạch cacbon (hàng dọc), nguyên từ khối tăng nhiệt độ sôi của các chất tăng dần.
- Khi nguyên tử khối tăng (theo hàng ngang), nhiệt độ sôi cùng giảm dần.
- Khi nguyên tử khối tăng cần tốn nhiều năng lượng để chuyển các phân tử hữu cơ sang trạng thái hơi nhiệt độ sôi tăng.
Bài 4 (trang 177 SGK Hóa 11): Từ axetilen, viết phương trình hoá học của các phản ứng điều chế: etyl bromua (1); 1,2-đibrometan (2); vinyl clorua (3); 1,1-đibrometan (4).
Bài giải: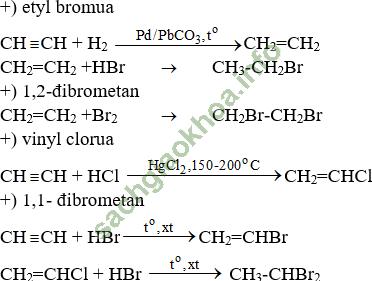
Bài 5 (trang 177 SGK Hóa 11): Dùng hai ống nghiệm, mỗi ống đựng 1ml một chất lỏng sau: etyl bromua (1), brombenzen (2). Thêm tiếp vào mỗi ống 1 ml dung dịch AgNO3. Đun sôi hai ống nghiệm thấy ở (1) có kết tủa vàng nhạt, trong khi đó ở ống (2) không có hiện tượng gì. Nhận xét, giải thích các hiện tượng thí nghiệm trên?
Bài giải:Ở ống (1) có phản ứng:
CH3-CH2-Br + H2O ![]() CH3-CH2-OH + HBr
CH3-CH2-OH + HBr
AgNO3 + HBr → AgBr ↓ + HNO3
(Kết tủa AgBr có màu vàng nhạt)
Ống (2):
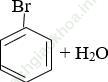 → không có phản ứng không có hiện tượng gì
→ không có phản ứng không có hiện tượng gìNhận xét: Liên kết C-Br mạch hở (trong CH3-CH2-Br) kém bên hơn liên kết của Br trực tiếp với C ở vòng benzen.
Bài 6 (trang 177 SGK Hóa 11): Khi đun nóng etyl clorua trong dung dịch chứa KOH và C2H5OH, thu được:
A. Etanol;
B. Etilen
C. Axetilen;
D. Etan
Bài giải:- Đáp án B