Bài 16 : Hợp chất của cacbon - Giải BT Hóa học 11
Bài 16: Hợp chất của cacbon
Bài 1 (trang 75 SGK Hóa 11): Làm thế nào để loại hơi nước và khí CO2 có lẫn trong khí CO? Viết các phương trình hóa học?
Bài giải:Cách để loại hơi nước và khí CO2 có lẫn trong khí CO như ssau:
- Dẫn hỗn hợp khí đi qua dung dịch nước vôi trong dư, khí cacbonic sẽ bị giữ lại
CO2 + Ca (OH)2 → CaCO3 + H2O
- Còn lại hơi nước và CO ta dẫn qua bình H2SO4 đặc thì hơi nước bị giữ lại, ta thu được khí CO.
Bài 2 (trang 75 SGK Hóa 11): Có ba chất gồm CO, HCl và SO2 đựng trong ba bình riêng biệt. Trình bày phương pháp hóa học để nhận biết từng chất khí. Viết các phương trình hóa học.
Bài giải:Phân biệt từng chất khí như sau:
- Để cánh hoa hồng lên miệng từng ống nghiệm, ống nào làm nhạt màu cánh hoa hồng là SO2.
- Dẫn hai khí còn lại qua dung dịch AgNO3 nếu thấy xuất hiện kết tủa màu trắng là khí HCl, nếu không thấy hiện tượng gì là CO.
Phương trình hóa học:
HCl + AgNO3 → AgCl↓ + HNO3
Bài 3 (trang 75 SGK Hóa 11): Điều nào sau đây không đúng cho phản ứng của khí CO và O2?
A. Phản ứng thu nhiệt.
B. Phản ứng tỏa nhiệt.
C. Phản ứng kèm theo sự giảm thể tích.
D. Phản ứng không xảy ra ở điều kiện thường.
Bài giải:Điều không đúng là A. Phản ứng thu nhiệt.
Bài 4 (trang 75 SGK Hóa 11):
a. Khi đun nóng dung dịch canxi hidrocacbonat thì có kết tủa xuất hiện. Tổng các hệ số tỉ lượng trong phương trình hóa học của phản ứng là:
A. 4;
B. 5;
C. 6;
D. 7
b. Khi cho dư khí CO2 vào dung dịch chứa kết tủa canxi cacbonat, thì kết tủa sẽ tan. Tổng các hệ số tỉ lượng trong phương trình hóa học của phản ứng là:
A. 4;
B. 5;
C. 6;
D. 7
Bài giải:(Hệ số tỉ lượng của phản ứng hóa học là số chỉ số nguyên tử, phân tử và ion của các chất tham gia tương tác được ghi trong phương trình phản ứng hóa học. Hay nói cách khác thì đó chính là các hệ số cân bằng trong phương trình hóa học. )
a. Đáp án đúng là A
Ca (HCO3)2 ![]() CaCO3 + CO2 + H2O
CaCO3 + CO2 + H2O
⇒ Tổng hệ số = 1 + 1 + 1 + 1 = 4
b. Đáp án đúng là: A
CaCO3 + CO2 + H2O → Ca (HCO3)2
⇒ Tổng hệ số = 1 + 1 + 1 + 1 = 4
Bài 5 (trang 75 SGK Hóa 11): Cho 224,0 ml CO2 (đktc) hấp thụ hết trong 100,0ml dung dịch kali hidroxit 0,200 M. Tính khối lượng của những chất có trong dung dịch tạo thành.
Bài giải: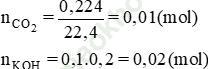
Ta có tỉ lệ:
⇒ Phương trình tạo muối trung hoà
CO2 + 2KOH → K2CO3 + H2O
⇒ Dung dịch sau phản ứng có
mK2CO3 = 0,01.138 = 1,38 g
Bài 6 (trang 75 SGK Hóa 11): Nung 52,65 g CaCO3 ở 100oC và cho toàn bộ lượng khí thoát ra hấp thụ hết vào 500,0 ml dung dịch NaOH 1,800M. Hỏi thu được những muối nào? Khối lượng là bao nhiêu? Biết rằng hiệu suất phản ứng nhiệt phân CaCO3 là 95%.
Bài giải:nNaOH = 1,8.0,5 = 0,9 (mol)
CaCO3 → CaO + CO2
Từ phương trình suy ra:
nCO2 = nCaCO3 = 0,5265 (mol)
Do hiệu suất phản ứng là 95% nên
⇒ nCO2 thực tế = 95%. 0,5265 = 0,500175 (mol)
⇒ Tạo ra hỗn hợp 2 muối
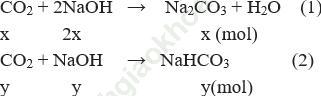
Ta có hệ phương trình:
⇒ mNa2CO3 = 0,399825.106 = 42,378 gam
mNaHCO3 = 0,10035.84 = 8,43 gam