Bài 33: Điều chế khí hiđro - Phản ứng thế - Giải BT Hóa học 8
Bài 33: Điều chế khí hiđro - Phản ứng thế
Bài 1: Những phản ứng hóa học nào dưới đây có thể được dùng để điều chế hiđro trong phòng thí nghiệm?
a) Zn + H2SO4 → ZnSO4 + H2.
b) 2H2O → 2H2 + O2.
c) 2Al + 6HCl → 2AlCl3 + 3H2.
Bài giải:Phản ứng hóa học điều chế hiđro trong phòng thí nghiệm là: a) và c)
Bài 2: Viết phương trình hóa học của các phản ứng sau và cho biết chúng thuộc loại phản ứng hóa học nào?
a) Mg + O2 → MgO.
b) 2KMnO4 → K2MnO4 + MnO2 + O2.
c) Fe + CuCl2 → FeCl2 + Cu.
Bài giải:a) Phản ứng:
2Mg + O2 → 2MgO.
Đây là phản ứng oxi hóa khử (phản ứng hóa hợp).
b) Phản ứng:
2KMnO4 → K2MnO4 + MnO2 + O2.
Đây là phản ứng oxi - hóa khử (phản ứng phân hủy).
c) Phản ứng:
Fe + CuCl2 → FeCl2 + Cu.
Đây là phản ứng thế.
Bài 3: Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí, phải để vị trí ống nghiệm như thế nào? Tại sao? Đối với khí hiđro, có làm như thế được không? Tại sao?
Bài giải:Vì khí O2 (M = 32) nặng hơn không khí (M = 29) nên khi thu khí oxi ta nên để ống nghiệm nghiêng hoặc để đứng.
Còn đối với khí H2 nhẹ hơn không khí nên khi thu khí phải úp ngược ống nghiệm không được để đứng ống nghiệm.
Bài 4: Trong phòng thí nghiệm hóa học có các kim loại kẽm và sắt, dung dịch HCl và axit H2SO4.
a) Viết các phương trình hóa học có thể điều chế hiđro;
b) Cần dùng bao nhiêu gam kẽm, bao nhiêu gam sắt để điều chế được 2,24 lít khí hiđro (đktc)?
Bài giải:a) Các phương trình hóa học của phản ứng như sau:
(1) Fe + H2SO4 → FeSO4 + H2.
(2) Zn + H2SO4 → ZnSO4 + H2.
(3) Fe + 2HCl → FeCl2 + H2.
(4) Zn + 2HCl → ZnCl2 + H2.
Theo phương trình (3) khối lượng Sắt cần dùng là: 56.0,1 = 5,6g.
Theo phương trình (4) khối lượng Kẽm cần dùng: 65.0,1 = 6,5g.
Bài 5: Cho 22,4 g sắt tác dụng với dung dịch loãng có chứa 24,5 g axit sunfuric.
a) Cho biết chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b) Xác định thể tích khí hiđro thu được ở đktc.
Bài giải: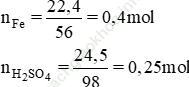
Phương trình hóa học của phản ứng như sau:
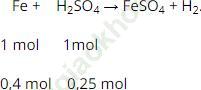
So sánh tỉ lệ ta thấy: ![]() ⇒ Fe dư
⇒ Fe dư
Theo phương trình: nFe (pư) = nH2SO4 = 0,25 mol
⇒ nFe dư = 0,4 – 0,25 = 0,15 mol
mFe dư = 0,15.56 = 8,4g.
Do khối lượng Fe dư nên tính thể tích khí H2 theo số mol H2SO4.
nH2 = nH2SO4 = 0,25 mol
Vkhí = 0,25.22,4 = 5,6l.